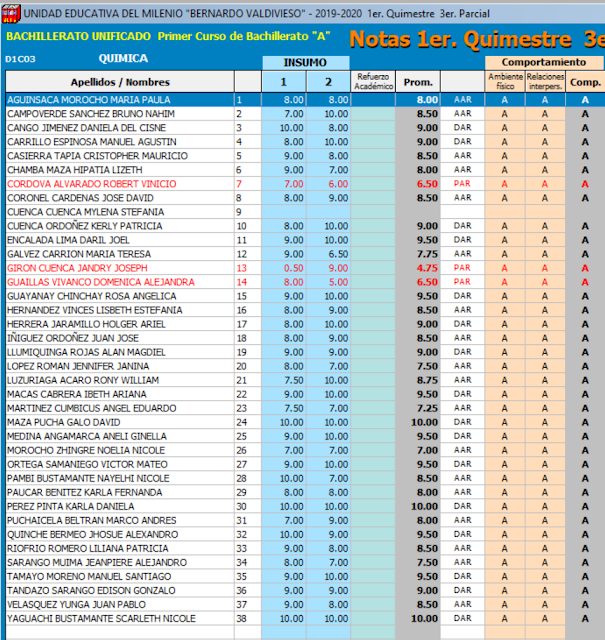
CALIFICACIONES QUÍMICA 1ro.BGU 3er PARCIAL 1QUIMESTRE
Calificaciones 3er parcial 1er quimestre.
FELICITACIONES POR EL ESFUERZO Y DEDICACIÓN, TODOS SOMOS CAPACES DE ALCANZAR EL ÉXITO, ÁNIMO Y MÁS DEDICACIÓN.
Contesta con verdadero “V” o falso “F” según corresponda.
PREPARA TU EXAMEN QUIMESTRAL.
CONTESTA
El Modelo de Dalton, fue el primer modelo atómico con bases científicas, fue formulado en 1808 por John Dalton. Este primer modelo atómico postulaba: La materia está formada por partículas muy pequeñas llamadas átomos, que son indivisibles y no se pueden destruir, permanecen sin división, aun cuando se combinen en las reacciones químicas. Sin embargo, desapareció ante el modelo de Thomson ya que no explica los rayos catódicos, la radioactividad ni la presencia de los electrones (e-) o protones(p+). (.…..)
La teoría atómica aceptada hoy sostiene que el átomo se compone de un núcleo de carga positiva formado por protones y neutrones, en conjunto conocidos como nucleones, alrededor del cual se encuentra una nube de electrones de carga negativa. (……)
El número cuántico principal siempre tiene como valor números enteros y positivos y nos permite conocer el nivel energético del orbital, así como su tamaño. N determina la medida del orbital, por lo que cuanto mayor sea n la probabilidad de encontrar un electrón cerca del núcleo de un átono disminuye y la energía del orbital se incrementa. Los valores que puede adoptar el número cuántico principal (n) pueden ser número enteros positivos como: n = -1/2 y +1/2 (…….)
El Modelo de Bohr, trata de incorporar los fenómenos de absorción y emisión de los gases, así como la nueva mecánica cuántica desarrollada por Max Planck y el fenómeno del efecto fotoeléctrico observado por Albert Einstein. “El átomo es un pequeño sistema solar con un núcleo en las orbitas y electrones dentro del núcleo, los electrones no radian energía (luz) mientras permanezcan en orbitas estables. Los electrones pueden saltar de una a otra orbita. Si lo hace desde una de menor energía a una de mayor energía absorbe un cuanto de energía. Si pasa de una de mayor a una de menor, pierde energía en forma de radiación (luz). (…….)




Comentarios
Publicar un comentario