Química. 1BGU, deberes, refuerzo, videos. etc.
Trabajo de recuperación
tarea extra clase para estudiantes con casos especiales
y sancionados con auscencia de las aulas.
No asistieron a clases por causas justificadas.
 UNIDAD EDUCATIVA EXP’ERIMENTAL BERNARDO VALDIVIESO
UNIDAD EDUCATIVA EXP’ERIMENTAL BERNARDO VALDIVIESO
Profesor:
Mgs. QUÍMICO: Luis Gilber Mosquera Cobos
__________________________________
Actividades correspondientes a 8H00 clase.
- 1. Lectura comprensiva de texto y subrayado de idea primcipal. Química 1BGU. Unidad 3.painas 77 a la 84 y la 86. (Las prácticas de laboratorio se efectuarán presencialmente. )
- 2. Observar Blog Educativo: realiza deber
- 3. Contesta el cuestionario en cuaderno de materia: texto Química pág. 88-89, preguntas de la 1 a la 16, luego autoevaluación.
presentar personalmente el estudiante en horario de case, firmado por representante y responsable DECE.
Prepara tu examen parcial
- Enlace que se da por la transferencia de electrones.
a. Enlace polar
b. Enlace iónico
c. Enlace covalente doble
d. Enlace covalente simple.
Enlace en el que se comparten un par de electrones.
a. Enlace covalente doble
b. Enlace covalente simple
c. Enlace covalente triple
d. Enlace apolar
/////////////////////////////////////////////////////////////////////////
UEMBV
DEBER PARA CARPETA.
-
HOJA A4.
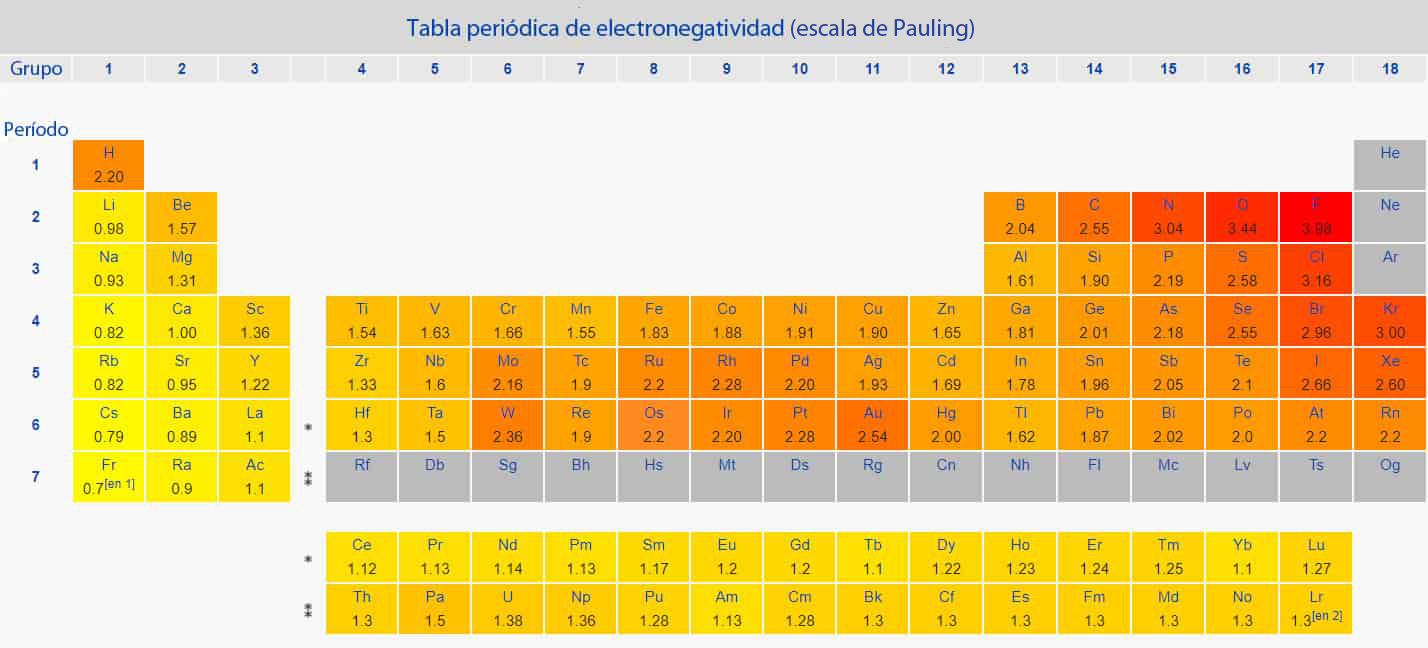
UTILIZANDO LA TABLA ANTERIOR CALCULAR LA DIFERENCIA DE ELECTRONEGATIVIDAD DE LOS ATOMOE QUE INTERVIENEN EN LA MOLECULA DEL COMPUESTO Y DETERMINAR EL TIPO DE ENLACE. PARA- ÓXIDO DE CALCIO: CaO
SULFATO DE ALUMNINIO Al2S3
TRIOXIDO DE AZUFRE: SO3
HIDRURO DE CALCIO: Ca H2
Desarrolla la formula de Lewis , comprueba la formula del octeto, representa los enlaces que unen la molécula y reconoce el número y los enlaces que la forman
ácido nítrico: HNO3
ácido sulfuroso: H2SO3.
%%%%%%%%%%%%%%%%%%%%%%%%%%
.%%%%%%%%%%%%%%%%%%%
- Refuerzo:- realiza la lectura comprensiva y analiza los ejemplos propuestos:
- RECUPERACION EXAMEN
AULA
Simbología de puntos de Lewis
Gilbert Lewis (químico estadounidense, 1875-1946) propuso que los átomos se combinan para formar moléculas siempre que ello conlleve alcanzar una configuración electrónica más estable. Esta configuración estable se alcanza, en muchos casos, cuando el átomo alcanza la configuración de gas noble o, dicho en otras palabras, cuando se rodea de 8 electrones en su nivel más externo.
Figura 3.2. Gilbert Lewis (1875-1946).
Tomado de: “Fisicanet” (http://www.fisicanet.com.ar/biografias/cientificos/l/lewis.php).
Los electrones que participan en la formación de enlaces (los del nivel energético más externo) se denominan electrones de valencia. Lewis desarrolló una simbología para denotar los electrones de valencia de cada átomo de la tabla periódica. Para ello, se coloca el símbolo de cada elemento y se rodea de puntos que representan a los electrones de valencia. En esta representación deben cumplirse reglas que ya hemos estudiado, como la regla de Hund.
Figura 3.3. Símbolos de puntos de Lewis para elementos de los bloques “s” y “p”.
TRABAJO DE RECUPERACIÓN. 2P AL EXAMEN
PARCIAL
en hoja A4, contesta:| Ejercicio .1
Analiza la figura 3.1 y observa el número de puntos que tiene cada elemento de la tabla.
|
Tema 2:
3.3. Enlace iónico
El enlace iónico está presente en todos los compuestos
iónicos, es decir, aquellos formados
por la unión de un catión y un anión.
Recuerda que:
·
Forman cationes
aquellos elementos con baja energía de ionización (izquierda de la
tabla), principalmente los metales de los grupos 1 y 2 de la tabla periódica.
·
Por otro lado,
los elementos con alta energía de ionización (no metales de la derecha
de la tabla periódica) tienden a ganar electrones y, por tanto, forman con
facilidad aniones, al ganar un electrón.
En consecuencia,
el enlace iónico se forma cuando un metal cede electrones a un no metal.
El metal se vuelve catión, alcanzando la configuración de gas noble, y el no
metal, aceptando electrones, completa su octeto, adquiriendo también una
configuración más estable. La atracción entre catión y anión es una fuerza
electrostática, denominada enlace iónico.
Formación de un
compuesto iónico
El fluroruro de
litio (LiF) es un compuesto iónico. Al estar compuesto por litio y flúor, estos
elementos se han tenido que combinar para formarlo. Analicemos cada elemento
por separado:
Li, elemento del
grupo 1, tiene un electrón de valencia y tendencia a formar cationes (perdiendo
un electrón). Si el litio pierde un electrón, adquiere la configuración
electrónica del helio (gas noble), formando el catión Li+.
F, elemento del
grupo 7, tiene siete electrones de valencia y tendencia a formar aniones
(ganando un electrón). Si el flúor gana un electrón, adquiere la configuración
electrónica del neón (gas noble), formando el anión F-.
Por tanto, si
entre ellos se combinan y el litio transfiere su electrón de valencia al flúor,
ambos ganan una gran estabilidad. Se estará formando el compuesto iónico LiF,
según la siguiente ecuación:
Observa la
configuración electrónica de cada elemento después de la transferencia de
electrones (lado derecho de la ecuación). Ambos elementos han alcanzado la
configuración del gas noble más cercano.
Aplicando el
principio de electroneutralidad, podemos deducir cuál será el compuesto iónico
que se formará entre el magnesio y el cloro:
Mg, elemento del
grupo 2, tiene dos electrones de valencia. Para alcanzar la configuración de
gas noble debe perder dos electrones, formando iones Mg2+.
Cl, elemento del
grupo 7, tiene siete electrones de valencia. Para alcanzar la configuración de
gas noble tiene que ganar un electrón., y forma el anión Cl-.
Usando el
principio de electroneutralidad, necesitamos dos aniones cloro (Cl-)
por cada catión magnesio (Mg2+) para obtener un compuesto estable.
Entonces, la ecuación de formación del cloruro de magnesio será:

Propiedades de los compuestos iónicos
·
Son sólidos a
temperatura ambiente.
·
Se disuelven en agua.
·
En estado sólido
no conducen la electricidad.
·
Conducen la
electricidad si se encuentran en estado líquido o si han sido disueltos en
agua.
·
Tienen alto
punto de fusión (temperatura de cambio de sólido a líquido), debido a la alta
energía reticular que poseen.
Ejercicio .2
Utiliza la simbología de
Lewis para explicar
la formación del compuesto iónico óxido de sodio (Na2O).
Resuelve:
BROMURO DE CALCIO: CaBr2
SULFURO PLUMBICO: PbS2
CLORURO DE SODIO: NaCl
|
%%%%%%%%%%%%%%%
FENECIO PLAZO ENTREGA.
OBSERVA LOS VIDEOS.
Trabaja en hojas para carpeta.
UNIDAD EDUCATIVA DEL MILENIO BERNARDO VALDIVIESO
ALUMNA/O
CURSO: PARALELO
FECHA DE ENTREGA.
TRABAJA DE REFUERZO Y RECUPERACIÓN 2do Parcial
1. ELABORA UN RESUMEN CORTO (10 A 15 LÍNEAS)
2. DESARROLLA LA CONFIGURACIÓN ELECTRÓNICA PARA
- ATOMOS: Fe, Cr,
- ANIONES: S, F, As
- CATIONES; Rb, Ra, Ag, Pt.
Presentar en horario clase hasta el 12 de diciembre
.
..
.
PREPARA TU EXAMEN QUIMESTRAL:
REVISA LAS DIAPOSITIVAS:
https://es.slideshare.net/Gabriel_Alvear/calcula-los-cuatro-nmeros-cunticos-del-orbital
REVISA LAS DIAPOSITIVAS:
https://es.slideshare.net/Gabriel_Alvear/calcula-los-cuatro-nmeros-cunticos-del-orbital


Este comentario ha sido eliminado por el autor.
ResponderEliminarlicenciado tenga usted muy buenas tardes ¿este es trabajo para los estudiantes de 1ero B.G.U."E"?
ResponderEliminarLicenciado muy buenas noches tal vez esto es todo el trabajo para los de primero "E"
ResponderEliminartenga un cordial saludo soy estudiante del 1ero bgu paralelo b y me pareció muy bien hecho el refuerzo y tal vez podría mejorar un poco la calidad de los vídeos y la información que nos hizo a conocer eso es todo que pasa bien
ResponderEliminarMe pareció muy interesante los vídeos me ayudaron a comprender mejor los temas y así también poder realizar el refuerzo lo cual se me hizo muy fácil espero sigan habiendo vídeos así
ResponderEliminarGracias Licenciado por el enlace para prepararnos para el examen quimestral, me ha sido de mucha ayuda.
ResponderEliminar