1ro BGU QUIMICA PROPIEDADES PERIODICAS
DEBER PARA FIN DE PARCIAL.
Investiga.
Estado de oxidación
Investiga.
TRABAJO
DE ANÁLISIS Y SÍNTESIS
PARA
FOMENTAR LA INVESTIGACIÓN
Utiliza
tus habilidades de lectura comprensiva y redacción
EN HOJA A4 (a
computadora o manuscrito)
- Extensión 1 hoja sin imágenes, 2 hojas si incluye imágenes pequeñas
- Espaciado, 1,15
- Letra y tamaño: Times New Roman 10 a 12
El uranio:
el elemento más polémico
https://www.bbc.com/mundo/noticias/2014/11/141031_finde_uranio_quimico_polemico_finde_ac
- Fecha entrega: . HASTA EL VIERNES 6 DE DICIEMBRE DE 2019 (EN HORARIO DE CLASE)
Estado de oxidación
En química, el estado de
oxidación (EO) es un indicador del grado de oxidación de un átomo que forma parte de un
compuesto
u otra especie química (por ejemplo un ion). Formalmente, es la carga eléctrica
hipotética que el átomo tendría si todos sus enlaces con elementos
distintos fueran 100 % iónicos. El EO es
representado por números, los cuales pueden ser positivos, negativos o cero. En
algunos casos, el estado de oxidación promedio de un elemento es una fracción,
tal como +8/3 para el hierro
en la magnetita (Fe3O4).
El mayor EO conocido es +8 para los tetra óxidos de rutenio, xenón, osmio, iridio, hassio y algunos compuestos
complejos de plutonio,
mientras que el menor EO conocido es -4 para algunos elementos del grupo del
carbono (elementos del
grupo 14).
La
oxidación se da cuando un elemento o compuesto pierde uno o más electrones. Generalmente,
cuando una sustancia
se oxida (pierde electrones), otra sustancia recibe o capta dichos electrones
reduciéndose. Este es el mecanismo básico que promueve las reacciones de
óxido-reducción o redox.
Enlace iónico. Un átomo dona electrones a otra especie, y
al tener cargas opuestas se atraen mutuamente.
En un enlace covalente apolar
ambos átomos comparten el par de electrones para cumplir la regla del octeto, no
obstante el de mayor electronegatividad
-en este caso el carbono- los atrae más fuertemente y se recibe una carga
parcial negativa (δ-); por el contrario, el
otro átomo -el hidrógeno- está más alejado del par de electrones y se carga
parcialmente de forma positiva (δ+). El EO busca cuantificar y explicar esta
interacción: el carbono tiene un EO de -4 y cada hidrógeno +1 y al sumarlos da
la carga de la molécula (0).
Un
átomo tiende a obedecer la regla del octeto para así
tener una configuración
electrónica igual a la de los gases nobles, los cuales
son muy estables químicamente (sus átomos no forman enlaces químicos casi con
nadie, ni siquiera con ellos mismos). Dicha regla sostiene que un átomo tiende
a tener ocho electrones en su nivel
de energía más externo. En el caso del hidrógeno este tiende a
tener 2 electrones, lo cual le proporcionaría la misma configuración
electrónica que la del helio.
Cuando
un átomo A necesita, por ejemplo, 3 electrones para obedecer la regla
del octeto, entonces dicho átomo tiende a tener un número de oxidación de -3,
cuando adquiera esos 3 electrones. Por otro lado, cuando un átomo B
tiene los 3 electrones que deben ser cedidos para que el átomo A cumpla la ley
del octeto, entonces este átomo tiende a tener un número de oxidación de 3+,
cuando ceda esos 3 electrones. En este ejemplo podemos deducir que los átomos A
y B pueden unirse para formar un compuesto, y que esto depende de las
interacciones entre ellos. La regla del octeto y del dueto pueden ser
satisfechas compartiendo electrones (formando compuestos covalentes, por ejemplo en moléculas como el agua) o
cediendo y adquiriendo electrones (formando compuestos iónicos como por ejemplo en
los cristales de cloruro de sodio).
Los
elementos químicos se dividen en 3 grandes grupos, clasificados por el tipo de
carga eléctrica que pueden adquirir al participar en una reacción
química:
·
Metales.
·
No metales.
·
Gases nobles.
Existen
elementos metálicos que, dependiendo de las condiciones a que sean sometidos,
pueden funcionar como metales o no metales indistintamente. A estos elementos
se les denomina semimetales o metaloides.
Los
elementos metálicos (los cuales tienden a ceder electrones) cuando forman
compuestos tienen normalmente estados de oxidación positivos. Los elementos no
metálicos y semimetálicos, en cambio, pueden tener estados de oxidación
positivos y negativos, dependiendo del compuesto que estén constituyendo.
Cloruro de sodio
2Na0
+ Cl02 → 2Na+1 + 2Cl-1
Los
gases de un solo tipo de elemento, en este caso el cloro, están presentes en
forma diatómica.
El sodio (Na)
se combina con el cloro (Cl),
produciendo cloruro de sodio. El número de oxidación de ambos elementos sin
combinar es 0 (cero), ya que están equilibrados eléctricamente. El número de
oxidación del sodio combinado es +1, ya que cede un electrón. El número de
oxidación del cloro combinado es -1, ya que acepta el electrón cedido por el
sodio.
Óxido de aluminio
Al0
+ O02 → Al3+ + 2O2−
El aluminio (Al)
se combina con el oxígeno (O), produciendo óxido de aluminio (Al2O3).
El número de oxidación de ambos elementos sin combinar es 0 (cero), ya que
están equilibrados eléctricamente. El número de oxidación del aluminio
combinado es 3+, ya que cede tres electrones. El número de oxidación del
oxígeno combinado es 2−, ya que acepta hasta 2 electrones.
Los
electrones cedidos y aceptados por los distintos elementos crean un problema
con las cargas eléctricas. Por ejemplo, el aluminio cede tres electrones y el
oxígeno sólo acepta dos, por lo que sobra uno. De esto se concluye que en la reacción no
interviene un solo átomo de oxígeno, por lo que se procede a balancear la
ecuación, para que coincidan todos los electrones transferidos con las
capacidades de cada elemento aceptor.
La
ecuación balanceada queda así:
4Al0
+ 3O02 → 4Al3+ + 6O2− → 2Al3+
+ 3O2−
Con lo
que se logra el balance perfecto para que se acomoden todos los electrones
excedentes. Los elementos de un elemento libre o en estado basal tienen un
número de oxidación igual a 0.
·
Todos los elementos
metálicos (los cuales ceden electrones) cuando forman compuestos tienen
generalmente estados de oxidación positivos.
·
Los elementos no
metálicos y semimetálicos pueden tener estados de oxidación positivos y
negativos, dependiendo del compuesto que estén constituyendo.
·
El mínimo estado de
oxidación posible de un elemento es 4−, y lo tienen algunos de los elementos
del grupo 4A.
·
Los no metales tienen un
estado de oxidación negativo único, que es igual al número de grupo menos 8.
·
Los elementos de los
grupos 1A y 2A poseen los estados de oxidación 1+ y 2+ respectivamente
·
El hidrógeno funciona
con estado de oxidación 1+ generalmente, a excepción cuando forma hidruros metálicos
en donde su estado de oxidación es 1−.
·
El número de oxidación
del O es 2−, excepto cuando forma peróxidos,
donde es 1−, y cuando forma superóxidos,
donde es 1/2−.
·
La suma de los estados
de oxidación de los elementos de un compuesto es igual a su carga neta.
1.
El estado de oxidación
de todos los elementos en estado libre, no combinados con otros, es de cero (p.
ej., Na, Cu, Mg, H2, O2, Cl2, N2).
2.
El estado de oxidación
del H es de +1, excepto en los hidruros metálicos, en los que es de -1 (p. ej.,
NaH, CaH2).
3.
El estado de oxidación
del O es de -2, excepto en los alcalinos los compuestos con flúor, los peróxidos, en
los que es de -1, en los superóxidos que
es -1/2 y en el fluoruro
de oxígeno (OF2), donde es de +2.
4.
El estado de oxidación
del elemento metálico de un compuesto iónico es positivo.
5.
En los compuestos
covalentes, el número de oxidación negativo se asigna al átomo más
electronegativo y todos los demás son positivos.
6.
La suma algebraica de
los estados de oxidación de los elementos de un compuesto es cero.
7. La
suma algebraica de los estados de oxidación de los elementos de un ion
poliatómico es igual a la carga del ion.1
//////////////////////&&&&&&&&&&&&&&&&&&&&&&&&&&&&//////////////////
 .
.
 .
.
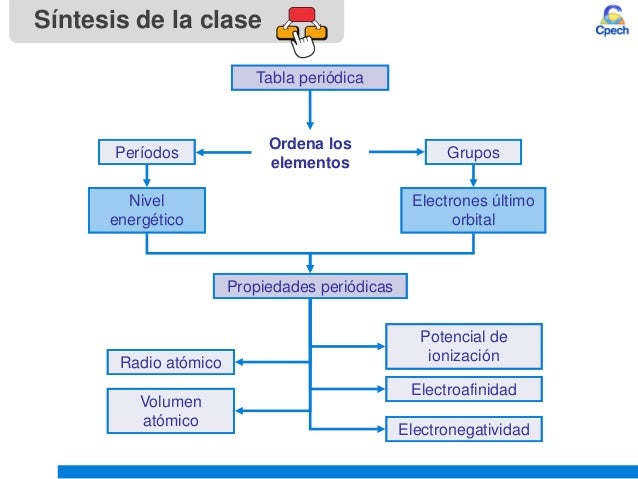
Las propiedades Periódicas y su variación en la tabla
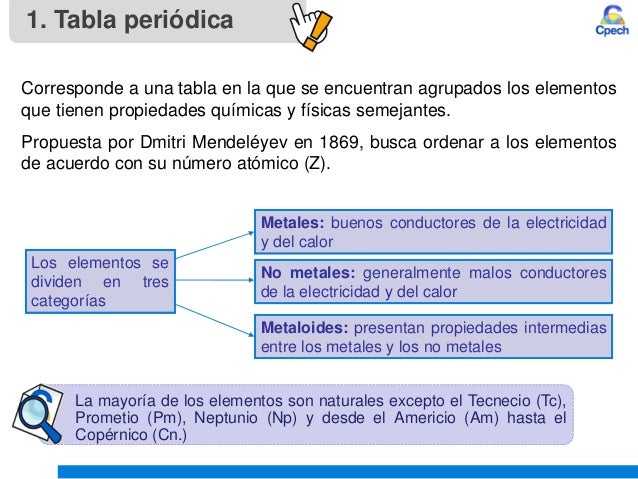
¿QUÉ SON LAS PROPIEDADES PERIÓDICAS?
Son
propiedades que presentan los elementos químicos y que se repiten
secuencialmente en la tabla periódica. Por la colocación en la misma de
un elemento, podemos deducir que valores presentan dichas propiedades,
así como su comportamiento químico.la variación de una de ellas en los
grupos va a responder a una regla general. Esto nos permite, al conocer
estas reglas de variación, cuál va a ser el comportamiento químico de un
elemento, ya que dicho comportamiento, depende en gran manera, de sus
propiedades periódicas.
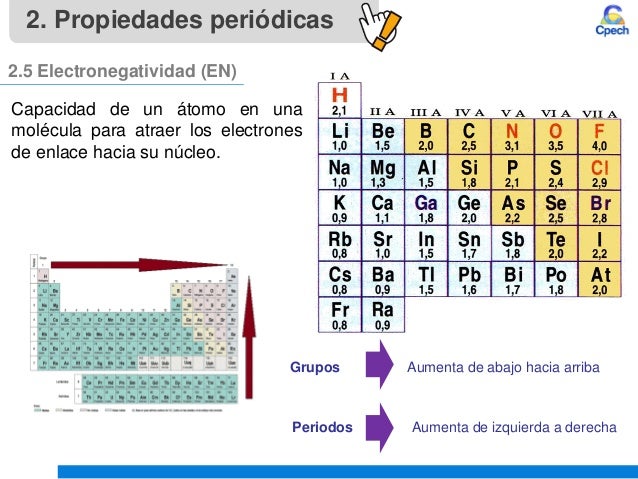
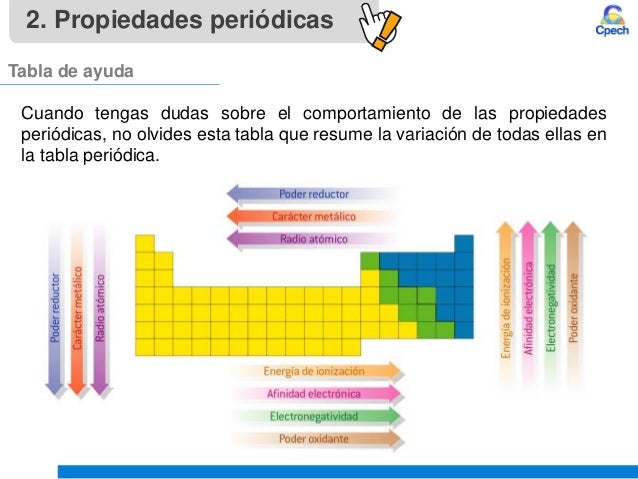
- · Electronegatividad
- Afinidad Electrónica
- Potencial de Ionización
- Radio atómico
- Radio Iónico
- Carácter metálico
 .
.- Grupo 1 (I A): los metales alcalinos
- Grupo 2 (II A): los metales alcalinotérreos
- Grupo 3 (III B): Familia del Escandio
- Grupo 4 (IV B): Familia del Titanio
- Grupo 5 (V B): Familia del Vanadio
- Grupo 6 (VI B): Familia del Cromo
- Grupo 7 (VII B): Familia del Manganeso
- Grupo 8 (VIII B): Familia del Hierro
- Grupo 9 (IX B): Familia del Cobalto
- Grupo 10 (X B): Familia del Níquel
- Grupo 11 (I B): Familia del Cobre
- Grupo 12 (II B): Familia del Zinc
- Grupo 13 (III A): los térreos
- Grupo 14 (IV A): los carbonoideos
- Grupo 15 (V A): los nitrogenoideos
- Grupo 16 (VI A): los calcógenos o anfígenos
- Grupo 17 (VII A): los halógenos
- Grupo 18 (VIII A): los gases nobles


Licenciado, la información ha sido bastante favorable para poder conocer sobre la energía de ionización, electronegatividad y carácter metálico.
ResponderEliminarla información de este blog me a ayudado a comprender aun mejor lo temas y conocer temas que desconocía y con respecto a la clase del video solo me ayudo a reforzar ya que en su clase podemos interactuar
ResponderEliminarEs de mucha utilidad el blog gracias
ResponderEliminarEste comentario ha sido eliminado por el autor.
ResponderEliminarLicenciado, la información ha sido muy interesante y necesaria para poder comprender el tema
ResponderEliminarEste comentario ha sido eliminado por el autor.
ResponderEliminarEste comentario ha sido eliminado por el autor.
ResponderEliminar