3er PARCIAL DOMINIO CIENTÍFICO:
PREGUNTAS PARA EXAMEN
.///////////////

%%%%%%%%%%%%%%%%%%%%%%
Fecha de entrega: según horario hasta miercoles 13/02/2019

ejemplo:
recuerde el collage consiste en armar los componntes del ecosistema como un rompe cabezas.
(no pegar una lámina completa)
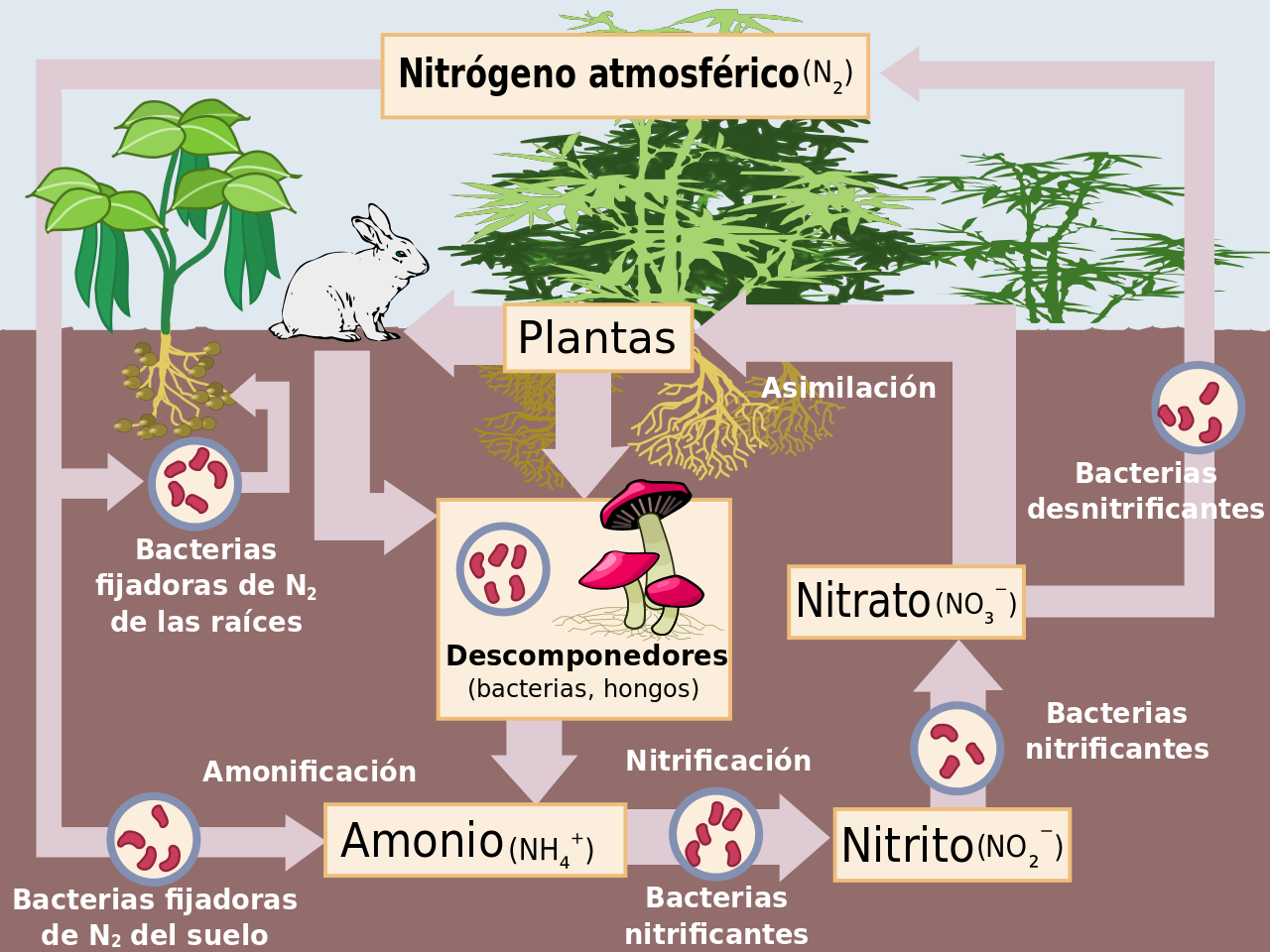
RECORTA LAS PARTES Y ATME TU CICLO.

%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%
.///////////////
- RECONOCE LOS ORGANISMNOS POR NIVEL

¿Cuántos litros de CO2 medidos en c.n se obtendrían en la combustión de 20 kg de gas butano C4H10?
a) Ecuación ..........................................................................
b) Cálculos:
- En la fotosíntesis el CO2 de la atmósfera se convierte en O2 según la reacción:
6CO2 + 6 H2O = C6H12O6 + 6O2
¿Cuántos gramos de O2 se obtienen en la fotosíntesis de 10 litros de CO2 medidos en c.n?
a) 22.4 litros de
O2
b) 10 litros
de O2
c) 5 litros de
O2
e) ninguna de las anteriores
%%%%%%%%%%%%%%%%%%%%%%
Fecha de entrega: según horario hasta miercoles 13/02/2019
ejemplo:
recuerde el collage consiste en armar los componntes del ecosistema como un rompe cabezas.
(no pegar una lámina completa)

RECORTA LAS PARTES Y ATME TU CICLO.
%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%
&&&&&&&&&&&&&&&&&&&&&&&&
Trabajo de Recuperación
Recuperación:

2
3
############################
UNIDAD EDUCATIVA BERNARDO VALDIVIESO
Trabajo de Recuperación
Recuperación:
Quienes NO HAYAN PRESENTADO UN DEBER, TIA, TCE, o tengan calificaciones en deberes, actividades clase TIA o trabajo cooperativo TCE, inferiores a 7 P, pueden recuperar su nota con un buen resumen de uno de los videos, de 10 a 15 lineas y la resolucion de un problema seleccionado de los siguientes, el ej. 1 o 2. . (debe dejar al final tambien su comentario para validar su tarea)
TRABAJO DE REFUERZO ACADÉMICO
ESTUDIANTE QUE REALIZA EL REFUERZO ACEDEMICO OBSERVANDO LOS VIDEOS, DEBE ESCOGER 1 VIDEO PARA HACER UN CORTO COMENTARIO AL FINAL DE ESTA ENTRADA, Y MEJORARA SU CALIFIACIÓN ( NO OLVODE EJAR SU COMBRES APELLIDOS Y PARALELO)
video 1.
############################
UNIDAD EDUCATIVA BERNARDO VALDIVIESO
SECCIÓN MATUTINA
PROFESOR: Mgs. LUIS GILBER MOSQUERA COBOS
FECHA: Lunes 7 de febrero de 2019
Fecha de entrega hasta el viernes 18 de enero de 2019 según horario de clase.
DEBER No. 2 DOMINIO CIENTÍFICO
Ejercicios de selección múltiple de estequiometria
1.- Con relación al concepto
de mol es correcto afirmar que:
I.- es una unidad de medida de
cantidad
II.- Es una unidad fija
III.- Representa exclusivamente átomos
individuales
a) Sólo
I b) I y
II c) II y
III d) I y
III e) I, II y III
2.- La estequiometría
define:
a) Las
relaciones cuantitativas entre elementos en los compuestos y entre las
sustancias cuando sufren cambios químicos..
b) Las
relaciones cualitativas entre átomos y moléculas.
c) Los
cambios físicos y químicos de los compuestos.
d) La
fórmula empírica de una sustancia.
e) La
formación de compuestos covalentes
3.- La fórmula molecular del
permanganato de potasio es:
a) MnO2
b) K2O
c) KMnO4
d) K2O3
e) HMnO4
4.- Una muestra de carbono
con una masa de 12.011 g contiene:
a) 6.02 X
1023 átomos de carbono o 1 mol de átomos de carbono
b) 6.02 X
1023 Moles de carbono
c) 6.02 X
1023 Moléculas de carbono
d) 12.011
moles de carbono
e) 12 uma
5.- La ley de las
proporciones múltiples enuncia:
I. Dos y a veces más elementos pueden formar más de un
compuesto.
II. Cuando dos elementos forman más de un compuesto, la
relación de masas puede expresarse en números enteros pequeños.
III. El número de átomos de un compuesto es igual al número
de moléculas.
IV. Los átomos y moléculas se combinan al azar.
a) I y II
b) II y
III c) III y
IV d) I y
IV e) II y IV
6.- Una fórmula química
describe:
I. Los modelos de las moléculas en un compuesto.
II. Los elementos presentes en un compuesto.
III. Los átomos aislados en la naturaleza.
IV. Las relaciones que se presentan entre los átomos de los
elementos
a) I y II
b) II y
III c) III y
IV d) I y
IV e) II y IV
7.- Los nombres que se le
pueden dar al compuesto Cu (NO3)2 son:
I. Nitrato cúprico.
II. Nitrito cuproso.
III. Nitrato de cobre.
IV. Nitrato de cobre II.
a) I y II
b) II y
III c) III y
IV d) I y
IV e) II y IV
8.- La unidad de masa
atómica (u.m.a) se define exactamente como 1/12 de la masa de un átomo de una
clase particular de átomos de carbono, llamados carbono 12 porque
el carbono tiene 12 protones y 12 neutrones:
a) La afirmación
y la razón son VERDADERAS y la razón es una EXPLICACIÓN CORRECTA
de la afirmación.
b) La afirmación
y la razón son VERDADERAS pero la razón NO ES una explicación
CORRECTA de la afirmación.
c) La afirmación
es VERDADERA pero la razón es FALSA.
d) La afirmación
es FALSA y la razón es VERDADERA.
e) La afirmación
y la razón son FALSAS.
9.- La síntesis industrial
del ácido nítrico se representa por la siguiente ecuación:
3NO2 (g) + H2O
(g) à
2HNO3 (ac)
+ NO(g)
En condiciones normales, un
mol de NO2 reacciona con suficiente agua para producir
a) 3/2
moles de HNO3
b) 4/3
moles de HNO3
c) 5/2
moles de HNO3
d) 2/3
moles de HNO3
e) 1/3
moles de HNO3
10.- De acuerdo con las
siguientes reacciones:
T + O2
--> V
V + H2O
--> Y
Y + HX
--> Z + H2O
Si X es un no metal del
Grupo VIIA y Z es una sal, V es:
a) un
óxido básico
b) un
óxido ácido
c) un
hidróxido
d) una sal
e) Hidruro
El aire está compuesto
apróximadamente de 21% de O2 y 79% de N2 (molar). Un
combustible se quema de acuerdo con la siguiente reacción
CH4 + 2O2
--> CO2 + 2H2O
11.- .Si se queman 10 moles
de CH4 utilizando 100 moles de aire, la cantidad de moles de O2
que sobra es apróximadamente:
a) 95
b) 1
c) 90
d) 5
e) No se
puede determinar
12.- Si reacciona 1
mol de CH4 en presencia de 3 moles de O2 en un recipiente
cerrado, la composición molecular final de la mezcla será:
a) 50% H2O,
25% O2, 25% CO2
b) 50% H2O,
50% CO2
c) 25% H2O,
25% O2, 50% CO2
d) 50% H2O,
50% O2
e) 25% O2,
57% H2O.
13.- La producción de
dióxido de carbono (CO2) y agua se lleva a cabo por la combustión
del propanol (C3H7OH). La ecuación que describe este
proceso es:
a) C3H7OH
--> 3 CO + H2O
b) C3H7OH
+ 4,5 O2 --> 3 CO2
+ 4 H2O
c) 3 CO2
+ 4 H2O -->
C3H7OH + 4,5 O2
d) 3 CO2
+ 4,5 H2O --> C3H7OH
e) Otra
reacción.
14.- En la
etiqueta de un frasco de vinagre aparece la información : <<solución de
ácido acético al 4% en peso>> el a4% en peso indica que el frasco
contiene.
a)
4g de ácido acético y 96g de
solución
b)
100g de soluto y 4g de ácido acético
c)
100g de solvente y 4g de ácido
acético
d)
4g de ácido acético en 100g de solución
e)
4 ml de ácido acético en 100 ml de solvente
15.- La masa molar del agua es de 18 gramos. Ello significa que:
a) Una
molécula de agua tiene una masa de 18 gramos.
b) 6 x 1023
moléculas de agua tienen una masa de 18 gramos.
c) 18
moléculas de agua tienen una masa de 1 gramo.
d) Una
molécula de agua tiene 18 x 6 x 1023 gramos.
e) Hay 18
moléculas en un gramo de agua
16.- La electrólisis es un
proceso en el que se utiliza la energía eléctrica para que se lleve a cabo una
reacción química no espontánea. La reacción de descomposición electrolítica del
agua es:
2 H2O(l)
-->
2 H2(g) + O2(g)
Para obtener 22,4 L de
oxígeno en condiciones normales de presión y temperatura, el agua que se deberá
descomponer, es:
(Masas atómicas: H=1 g/mol
O=16 g/mol)
a) 2
moléculas.
b) 2
litros.
c) 2 x
6,02 x 1023 moles.
d) 2
g.
e) Ninguna
de las anteriores.
17.- Lavoiser fue el primero
en demostrar que el agua no era un elemento, sino un compuesto que se forma a
partir de dos gases: Hidrógeno y Oxígeno. Si el hidrógeno y oxígeno son los dos
elementos constituyentes del agua, entonces el porcentaje en masa del hidrógeno
en el agua, es
(Masas
atómicas: H = 1 O = 16)
a) 50 %
b) 33,33%.
c) 11,11%.
d) 5,88%.
e)
1,00%.
TEST INTERACTIVO, INGRESAR Y APLICAR
:::::::::::::::::::::::::::::::::::::::::::::::::::
FIRMA DEL REPRESENTANTE.
&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&
UNIDAD EDUCATIVA BERNARDO VALDIVIESO
SECCIÓN MATUTINA
PROFESOR: Mgs. LUIS GILBER MOSQUERA COBOS
ALUMNO/A: ........................................................................ CURSO: .............................PARALELO:...........................
FECHA: Lunes 7 de febrero de 2019
Fecha de entrega hasta el viernes 11 de enero de 2019 según horario de clase.
DEBER No. 2 CORRECCI{ON DEL EXAMEN
1. FIRMADO POR SU REPRESENTANTE.
Buenas noches licenciado, por favor podría ayudarme con el ejercicio 16 de el deber. Gracias
ResponderEliminarBuenos días licenciado, para mi es muy interesante y a la ves muy educativo todos los videos que usted coloca en el blog, ya que usted trata de hacernos comprender a nosotros los estudiantes por medio de los mismos. Y por mi parte me ayuda demasiado a comprender más los temas explicados.
ResponderEliminarSoy Lady Monserrath Ramírez Miranda del 3ero BGU “I”.
Buenas noches licenciado a mi punto de vista todos lo vídeos son muy interesantes tanto para nosotros los estudiantes para así tener un buen conocimiento y comprender los temas que nos ha podido dar a conocer.
ResponderEliminarSoy Stefany Lizbeth Medina Guachizaca del 3° BGU "I"
Buenas tardes licenciado me parece muy interesante todos estos vídeos ya que ayuda mucho para nuestro aprendizaje ya que a veces en el aula no captamos muy bien lo que usted nos explica por distraídos pero con estos refuerzos que usted nos da comprenderemos mejor
ResponderEliminarSoy Belia Carrion de tercero de bachillerato "I"
Gracias licen por la recuperacion.
ResponderEliminarGracias por la recuperacuión licen
ResponderEliminarAtt: johanna baez😇
Buenas Tardes Magister, cada uno de los vídeos en lo personal me ha permitido profundizar más en mis conocimientos, muchas gracias por la información y por poder permitirnos recuperar y mejorar nuestro aprendizaje.
ResponderEliminarAtt: María Fernanda Sigcho Valencia
Curso: 3ero BGU "I"
Buenas noches licenciado , pienso que este blog fue creado con el objetivo de despejar cualquier duda que nos surja en cualquiera de sus clases por lo que pienso que es una buena técnica para perfeccionar o progresar en nuestro estudio.
ResponderEliminarAtte: Juan Pablo Villavicencio Márquez
Curso: 3ro BGU "I"
Buenas noches, permitame agradecerle por los videos ya que nos permiten darnos una mejor idea sobre el tema y como en uno de ellos nos explica que en nuestra vida diaria podemos encontrar los temas q tratamos y que de esa manera también podemos aprender a analizar y resolver los ejercicios planteados en clase.
ResponderEliminarAlumna: Erika Abad
Curso: Tercer año de BGU paralelo "I"
Buenas noches,al analizar estos vídeos nos ayudan a comprender de una mejor manera el tema de Reactivo limitante y en exceso, a pesar de no haber asistido a dicha clase, los vídeos me ayudaron a realizar este refuerzo, muchas gracias.
ResponderEliminarAlumna: Nicole Ortiz Rivera
Curso/paralelo: 3ro BGU "I".