Practicas de laboratorio, formato. Práctica 1
 .
.
&&&&&&&&&
.
UNIDAD EDUCATIVA DEL MILENIO
"BERNARDO VALDIVIESO"
QUÍMICA ORGÁNICA
Profesor: Mgs. Luis Gilber Mosquera Cobos
Práctica de Laboratorio No.3
I) TEMA: OBTENCIÓN DEL ACETILENO EN EL LABORATORIO II.) OBJETIVO.- Obtener y reconocer las propiedades del acetileno.
III.) FUNDAMENTO CIENTÍFICO. Ingresar a los link y resumir en 10 lineas el FC.
http://quimicaorganica2im43.blogspot.com/2013/10/acetileno.html
https://repository.uaeh.edu.mx/bitstream/discover
IV. ) MATERIALES:
Probetas para gaces 3
Soporte universal
Pinza doble nuez
Balon de destilación
Manguera de goma o de caucho
Cristalizador o cuba hidroneumática
Carbonato de alumninio Carburo de Calcio pulverizado: Ca2C
Agua destilada,
Cerillos
vidrios, lunas de reloj plano.
V.) EXPERIMENTOS: (describa el proceso)
1. Se Arma el soporte universal, la pinza doble nuez y asegura el balon de desrilación
Pinza doble nuez
Balon de destilación
Manguera de goma o de caucho
Cristalizador o cuba hidroneumática
Carbonato de alumninio Carburo de Calcio pulverizado: Ca2C
Agua destilada,
Cerillos
vidrios, lunas de reloj plano.
1. Se Arma el soporte universal, la pinza doble nuez y asegura el balon de desrilación
Proponga las reacciones quimicas sucedidas en el proceso
GRÁFICOS:(graficos o fotografías)
VI. CONCLUSIONES:
Proponga las reacciones quimicas sucedidas en el proceso
VI. CONCLUSIONES:
&&&&&&&&&&&&&&&&&&&&&&&&
&&&&&&&&&&&&&&&

UNIDAD EDUCATIVA DEL MILENIO
"BERNARDO VALDIVIESO"
QUÍMICA ORGÁNICA
Profesor: Mgs. Luis Gilber Mosquera Cobos
Práctica de Laboratorio No.2
- TEMA: OBTENCIÓN DE METANO EN EL LABORATORIO.
- OBJETIVO.- Obtener y reconocer la presencia del METANO pormedio de sus propiedades quimicas.
- FUNDAMENTO CIENTÍFICO. (máximo 10 lineas)El metano es el hidrocarburo saturado de cadena más corta que existe. Su
fórmula química es CH4, en la que cada uno de los átomos de hidrógeno
está unido a un átomo de carbono a través de un enlace covalente.
Es una sustancia incolora y no polar, que se presenta en forma de gas a
temperaturas y presiones ordinarias y se caracteriza por su baja Solubilidad en fase líquida y elevada persistencia en la atmósfera. . https://www.uaeh.edu.mx/scige/boletin/prepa3/n4/m2.html
- MATERIALES:
Probetas para gaces 3
Soporte universal
Pinza doble nuez
Balon de destilación
Manguera de goma o de caucho
Cristalizador o cuba hidroneumática
Carbonato de alumninio Ca3Al2
Agua destilada, Cerillos
vidrio de reloj plano.
5. EXPERIMENTOS:
1. Se Arma el soporte universal, la pinza doble nuez y asegura el balon de desrilación-----------
2. ........................................
3. .......................................
reacciones quimicas
6. GRÁFICOS:(graficos o fotografías)

7. COMCLUSIONES:
a.- ..................................
b.-
......................................... ......................................................
Firma Alumno. Firma del representante.
&&&&&&&&&&
UNIDAD EDUCATIVA DEL MILENIO
"BERNARDO vALDIVIESO"
QUÍMICA ORGÁNICA
Profesor: Mgs. Luis Gilber Mosquera Cobos
Práctica de Laboratorio No.1
- TEMA: Reconocimiento del Carbono en las sustancias orgánicas.
- OBJETIVO.- Reconocer la presencia del carbono pormedio de diversas reacciones químicas.
- FUNDAMENTO CIENTÍFICO.
- MATERIALES:
- GRADILLA CON TUBOS DE ENSAYO
- ÄCIDO SULFÚRICO CONCENTRADO
- GLUCOSA FRUCTOSA SACAROSA ALMIDON
- Lámina de carton
- Cerillos
- Vidrio de reloj
- Capsula de Porcelana
- Mechero a gas
- Tallos verdes (sauce)
5. EXPERIMENTOS:
6. GRÁFICOS:
7. COMCLUSIONES:
a.-
Firma Alumno. Firma del representante.
%%%%%%%%%%%%%%%%%%%%%%%%%%%%
Efectos del metano en el cambio climáticco
http://www.cdtdegas.com/images/Descargas/Nuestra_revista/MetFlu9/3_Efectos_del_Metano.pdf
%%%%%%%%%%%%%%%%%%%%%%%%
Hidrocarburos saturados
Alcanos
Los alcanos, o también llamados parafinas, pueden
representarse por la fórmula general:


Cada átomo de carbono distribuye sus orbitales
orientándolos hacia los vértices de un tetraedro (hibridación sp3).
A medida que aumenta el número de carbonos se disponen espacialmente en forma
de zig‑zag, tal y como se muestra en la
figura de la derecha que representa al hidrocarburo de 8 átomos de carbono
(octano).
Si la cadena es lineal, el hidrocarburo se nombra
con un prefijo indicando el número de átomos de carbono existentes y el
sufijo ‑ano:
Nombre
nº de átomos de C
Fórmula semidesarrollada
Metano
1
CH4
Etano
2
CH3
‑ CH3
Propano
3
CH3
‑ CH2 ‑ CH3
Butano
4
CH3
‑ (CH2)2 ‑ CH3
Pentano
5
CH3
‑ (CH2)3 ‑ CH3
Hexano
6
CH3
‑ (CH2)4 ‑ CH3
Heptano
7
CH3
‑ (CH2)5 ‑ CH3
Octano
8
CH3
‑ (CH2)6 ‑ CH3
Nonano
9
CH3
‑ (CH2)7 ‑ CH3
Decano
10
CH3
‑ (CH2)8 ‑ CH3
Undecano
11
CH3
‑ (CH2)9 ‑ CH3
Dodecano
12
CH3
‑ (CH2)10 ‑ CH3
Tridecano
13
CH3
‑ (CH2)11 ‑ CH3
Tetradecano
14
CH3
‑ (CH2)12 ‑ CH3
Eicosano
20
CH3
‑ (CH2)18 ‑ CH3
A partir del propano, en el siguiente compuesto
(C4H10), se pueden presentar dos posibilidades, la
cadena lineal o ramificada:
Isómeros son compuestos diferentes con la misma
fórmula.
4
átomos de carbono

2 isómeros
7
átomos de carbono

9 isómeros
14
átomos de carbono

1858
isómeros
Debe existir una nomenclatura adecuada para
poderlos nombrar a todos. Para ello tenemos que seguir los siguientes pasos:
1.
Establecer
la cadena más larga del
compuesto a considerar y si existen varias posibilidades, la más sustituida.
 2.
Nombrar los
sustituyentes: Los
sustituyentes se nombrarán de acuerdo con el hidrocarburo de idéntico número
de átomos de carbono cambiando su terminación ‑ano por la de ‑il o ‑ilo. Hay
que tener en cuenta que los radicales ramificados más sencillos tienen
nombres especiales:
2.
Nombrar los
sustituyentes: Los
sustituyentes se nombrarán de acuerdo con el hidrocarburo de idéntico número
de átomos de carbono cambiando su terminación ‑ano por la de ‑il o ‑ilo. Hay
que tener en cuenta que los radicales ramificados más sencillos tienen
nombres especiales:
Fórmula del radical
nombre del hidrocarburo
nombre del radical

Metano
Metil

Etano
Etil

Propano
Propil

propano
isopropilo

metilpropano
isobutilo

butano
secbutilo

metilpropano
terbutilo

propeno
vinilo
3.
Numerar la
cadena principal: La cadena
principal se numera de un extremo al otro escogiendo aquel sentido en el que
se dé a los sustituyentes el número más bajo posible.
 4.
Cuando hay
varios sustituyentes idénticos, se agrupan indicando con un prefijo el número de ellos, (di, tri,
tetra ... ), pero numerándolos todos según sus posiciones.
4.
Cuando hay
varios sustituyentes idénticos, se agrupan indicando con un prefijo el número de ellos, (di, tri,
tetra ... ), pero numerándolos todos según sus posiciones.
 en el ejemplo que nos ocupa hay dos metil, ambos
en el carbono 2 y un etil en el carbono 4.
en el ejemplo que nos ocupa hay dos metil, ambos
en el carbono 2 y un etil en el carbono 4.
5.
Los
sustituyentes se nombran por orden alfabético (sin incluir el prefijo multiplicativo) y a
continuación el nombre del hidrocarburo correspondiente a la cadena
principal. Los números que indican las posiciones de los sustituyentes se
separan por comas, y las ramificaciones por guiones:

6.
Cuando el
sustituyente es a su vez ramificado se nombran sus ramificaciones como sustituyentes, empezando a nombrar
los átomos de carbono por el más cercano a la cadena principal. Por ejemplo:

7.
Si la cadena
de átomos de carbono es cerrada se llama
con el prefijo ciclo y el nombre del hidrocarburo con el mismo número de
átomos de carbono.

 Hidrocarburos insaturados
Hidrocarburos insaturados
Hidrocarburos Aromáticos
La característica común de todos los hidrocarburos
aromáticos es que presentan un anillo cíclico de seis átomos de carbono con
tres enlaces dobles alternados y sin embargo no presentan las reacciones
típicas de los alquenos (adición y oxidación del doble enlace).
La moderna teoría de orbitales moleculares, explica la
estructura del benceno (molécula aromática más sencilla) suponiendo que los
orbitales p de los átomos de carbono crean una densidad electrónica continua
paralela al plano del anillo y los electrones de dichos orbitales p, están
deslocalizados a lo largo del anillo lo que hace que estos supuestos dobles
enlaces no sean atacados. Entonces la estructura del benceno se representará
de la siguiente forma:

Los
principales hidrocarburos aromáticos son:
Compuesto
Nombre
Pfusión
(ºC)
Pebullición
(ºC)
Densidad
a 20 ºC (gr/cm3 )

Benceno
5,5
80,1
0,879

Tolueno
-
9,5
110,6
0,867

o
- xileno
-
25,2
144,4
0,880

m
- xileno
-
47,9
139,1
0,864

p
- xileno
13,3
138,4
0,861

Bifenilo
69,2
254
-------

Estireno
-
30,6
145,2
0,906

Naftaleno
80,3
218
-------

Antraceno
216,2
340
-------
Fecha de entrega: del 10 al 13 de octubre de
2017, en horario de clase.
UNIDAD EDUCATIVA DEL MILENIO
"BERNARDO VALDIVIESO"
QUÍMICA ORGÁNICA
Profesor: Mgs. Luis Gilber Mosquera Cobos
Práctica de Laboratorio No.2
- TEMA: OBTENCIÓN DE METANO EN EL LABORATORIO.
- OBJETIVO.- Obtener y reconocer la presencia del METANO pormedio de sus propiedades quimicas.
- FUNDAMENTO CIENTÍFICO. (máximo 10 lineas)El metano es el hidrocarburo saturado de cadena más corta que existe. Su fórmula química es CH4, en la que cada uno de los átomos de hidrógeno está unido a un átomo de carbono a través de un enlace covalente. Es una sustancia incolora y no polar, que se presenta en forma de gas a temperaturas y presiones ordinarias y se caracteriza por su baja Solubilidad en fase líquida y elevada persistencia en la atmósfera. . https://www.uaeh.edu.mx/scige/boletin/prepa3/n4/m2.html
- MATERIALES:
Probetas para gaces 3
Soporte universal
Pinza doble nuez
Balon de destilación
Manguera de goma o de caucho
Cristalizador o cuba hidroneumática
Carbonato de alumninio Ca3Al2
Agua destilada, Cerillos
vidrio de reloj plano.
5. EXPERIMENTOS:
1. Se Arma el soporte universal, la pinza doble nuez y asegura el balon de desrilación-----------
2. ........................................
3. .......................................
reacciones quimicas
6. GRÁFICOS:(graficos o fotografías)

7. COMCLUSIONES:
a.- ..................................
b.-
......................................... ......................................................
Firma Alumno. Firma del representante.
Pinza doble nuez
Balon de destilación
Manguera de goma o de caucho
Cristalizador o cuba hidroneumática
Carbonato de alumninio Ca3Al2
Agua destilada, Cerillos
vidrio de reloj plano.
1. Se Arma el soporte universal, la pinza doble nuez y asegura el balon de desrilación-----------
reacciones quimicas
b.-
&&&&&&&&&&
UNIDAD EDUCATIVA DEL MILENIO
"BERNARDO vALDIVIESO"
QUÍMICA ORGÁNICA
Profesor: Mgs. Luis Gilber Mosquera Cobos
Práctica de Laboratorio No.1
- TEMA: Reconocimiento del Carbono en las sustancias orgánicas.
- OBJETIVO.- Reconocer la presencia del carbono pormedio de diversas reacciones químicas.
- FUNDAMENTO CIENTÍFICO.
- MATERIALES:
- GRADILLA CON TUBOS DE ENSAYO
- ÄCIDO SULFÚRICO CONCENTRADO
- GLUCOSA FRUCTOSA SACAROSA ALMIDON
- Lámina de carton
- Cerillos
- Vidrio de reloj
- Capsula de Porcelana
- Mechero a gas
- Tallos verdes (sauce)
5. EXPERIMENTOS:
6. GRÁFICOS:
7. COMCLUSIONES:
a.-
Firma Alumno. Firma del representante.
%%%%%%%%%%%%%%%%%%%%%%%%%%%%
Efectos del metano en el cambio climáticco
http://www.cdtdegas.com/images/Descargas/Nuestra_revista/MetFlu9/3_Efectos_del_Metano.pdf
%%%%%%%%%%%%%%%%%%%%%%%%
Efectos del metano en el cambio climáticco
http://www.cdtdegas.com/images/Descargas/Nuestra_revista/MetFlu9/3_Efectos_del_Metano.pdf
%%%%%%%%%%%%%%%%%%%%%%%%
Alcanos
Los alcanos, o también llamados parafinas, pueden
representarse por la fórmula general:

Cada átomo de carbono distribuye sus orbitales
orientándolos hacia los vértices de un tetraedro (hibridación sp3).
A medida que aumenta el número de carbonos se disponen espacialmente en forma
de zig‑zag, tal y como se muestra en la
figura de la derecha que representa al hidrocarburo de 8 átomos de carbono
(octano).
Si la cadena es lineal, el hidrocarburo se nombra
con un prefijo indicando el número de átomos de carbono existentes y el
sufijo ‑ano:
A partir del propano, en el siguiente compuesto
(C4H10), se pueden presentar dos posibilidades, la
cadena lineal o ramificada:
Isómeros son compuestos diferentes con la misma
fórmula.
Debe existir una nomenclatura adecuada para
poderlos nombrar a todos. Para ello tenemos que seguir los siguientes pasos:
1.
Establecer
la cadena más larga del
compuesto a considerar y si existen varias posibilidades, la más sustituida.

2.
Nombrar los
sustituyentes: Los
sustituyentes se nombrarán de acuerdo con el hidrocarburo de idéntico número
de átomos de carbono cambiando su terminación ‑ano por la de ‑il o ‑ilo. Hay
que tener en cuenta que los radicales ramificados más sencillos tienen
nombres especiales:
3.
Numerar la
cadena principal: La cadena
principal se numera de un extremo al otro escogiendo aquel sentido en el que
se dé a los sustituyentes el número más bajo posible.

4.
Cuando hay
varios sustituyentes idénticos, se agrupan indicando con un prefijo el número de ellos, (di, tri,
tetra ... ), pero numerándolos todos según sus posiciones.

en el ejemplo que nos ocupa hay dos metil, ambos
en el carbono 2 y un etil en el carbono 4.
5.
Los
sustituyentes se nombran por orden alfabético (sin incluir el prefijo multiplicativo) y a
continuación el nombre del hidrocarburo correspondiente a la cadena
principal. Los números que indican las posiciones de los sustituyentes se
separan por comas, y las ramificaciones por guiones:

6.
Cuando el
sustituyente es a su vez ramificado se nombran sus ramificaciones como sustituyentes, empezando a nombrar
los átomos de carbono por el más cercano a la cadena principal. Por ejemplo:

7.
Si la cadena
de átomos de carbono es cerrada se llama
con el prefijo ciclo y el nombre del hidrocarburo con el mismo número de
átomos de carbono.
 |

Hidrocarburos Aromáticos
La característica común de todos los hidrocarburos
aromáticos es que presentan un anillo cíclico de seis átomos de carbono con
tres enlaces dobles alternados y sin embargo no presentan las reacciones
típicas de los alquenos (adición y oxidación del doble enlace).
La moderna teoría de orbitales moleculares, explica la
estructura del benceno (molécula aromática más sencilla) suponiendo que los
orbitales p de los átomos de carbono crean una densidad electrónica continua
paralela al plano del anillo y los electrones de dichos orbitales p, están
deslocalizados a lo largo del anillo lo que hace que estos supuestos dobles
enlaces no sean atacados. Entonces la estructura del benceno se representará
de la siguiente forma:

Los
principales hidrocarburos aromáticos son:
|
Normas para elegir la cadena principal (Alcanos)
Debemos distinguir entre alcanos y compuestos orgánicos en general. La elección de la cadena principal
en alcanos se basa en las siguientes reglas.
Se escoge como cadena principal de un alcano la que tenga:
1. El mayor número de átomos de carbono.
2. El mayor número de cadenas laterales.
3. Localizadores más bajos para las cadenas laterales.
Normas para elegir la cadena principal (Compuestos orgánicos en general)
Se elige como cadena principal aquella que tenga:
1. El máximo número de grupos funcionales (es un único tipo de función)
2. El máximo número de dobles y triples enlaces (suma de ambos)
3. Mayor número de átomos de carbono.
4. Mayor número de dobles enlaces.
5. Localizadores más bajos para los grupos funcionales.
Normas para numerar la cadena (o ciclo) principal
Se numera la cadena principal de modo que se otorguen los localizadores más bajos a:
1. Los grupos funcionales.
2. Los dobles y triples enlaces (en conjunto).
3. Los dobles enlaces.
4. Los sustituyentes.
5. Los sustituyentes por orden alfabético.
$$$$$$$$$$$$$$$$$$$$$$$$$$$%%%%%%%%%%%%%%%%
Realizar una lectura
Construye un ensayo de máximo 300 palabras y destaca la importancia y aplicaciones. (manuscrito o impreso.) entrega hasta el 6 de octubre.
Presentalo a tu profesor para luego sustentarlo ante los compañeros
¿Qué es el carbón activado?
Últimamente se ha puesto de moda
hablar sobre el carbón activado en el campo de la medicina natural.
El carbón activado es un tipo de carbón especialmente poroso que tiene la cualidad de atrapar diferentes compuestos como metales pesados, gases, toxinas, algunas proteínas y productos de desecho. Desde 1550 a.C se ha utilizado como una sustancia capaz de purificar tanto el agua y aire como el propio cuerpo humano, gracias a que puede absorber las toxinas existentes tanto en el medio externo como en el cuerpo. Por ejemplo, es utilizado para diversos fines, entre ellos paliar una resaca, reducir el colesterol "malo", evitar intoxicaciones con sustancias venenosas y curar los problemas estomacales. Para entendernos mejor, es una especie de purificante y antídoto dentro del campo de la medicina.El carbón activado o carbón activo es carbón poroso que atrapa compuestos, principalmente orgánicos, presentes en un gas o en un líquido. Lo hace con tal efectividad, que es el purificante más utilizado por el ser humano.
Los compuestos orgánicos se derivan del metabolismo de los seres vivos, y su estructura básica consiste en cadenas de átomos de carbono e hidrógeno. Entre ellos se encuentran todos los derivados del mundo vegetal y animal, incluyendo el petróleo y los compuestos que se obtienen de él.
A la propiedad que tiene un sólido de adherir a su paredes una molécula que fluye, se le llama “adsorción”. Al sólido se le llama “adsorbente” y a la molécula, “adsorbato”.
El carbón activado es un tipo de carbón especialmente poroso que tiene la cualidad de atrapar diferentes compuestos como metales pesados, gases, toxinas, algunas proteínas y productos de desecho. Desde 1550 a.C se ha utilizado como una sustancia capaz de purificar tanto el agua y aire como el propio cuerpo humano, gracias a que puede absorber las toxinas existentes tanto en el medio externo como en el cuerpo. Por ejemplo, es utilizado para diversos fines, entre ellos paliar una resaca, reducir el colesterol "malo", evitar intoxicaciones con sustancias venenosas y curar los problemas estomacales. Para entendernos mejor, es una especie de purificante y antídoto dentro del campo de la medicina.El carbón activado o carbón activo es carbón poroso que atrapa compuestos, principalmente orgánicos, presentes en un gas o en un líquido. Lo hace con tal efectividad, que es el purificante más utilizado por el ser humano.
Los compuestos orgánicos se derivan del metabolismo de los seres vivos, y su estructura básica consiste en cadenas de átomos de carbono e hidrógeno. Entre ellos se encuentran todos los derivados del mundo vegetal y animal, incluyendo el petróleo y los compuestos que se obtienen de él.
A la propiedad que tiene un sólido de adherir a su paredes una molécula que fluye, se le llama “adsorción”. Al sólido se le llama “adsorbente” y a la molécula, “adsorbato”.
Después de la filtración -que tiene por objeto retener sólidos
presentes en un fluido-, no existe un sólo proceso de purificación con
más aplicaciones que el carbón activado. Entre ellas están:
- Potabilización de agua (el carbón retiene plaguicidas, grasas, aceites, detergentes, subproductos de la desinfección, toxinas, compuestos que producen color, compuestos originados por la descomposición de algas y vegetales o por el metabolismo de animales…)
- Deodorización y purificación de aire (por ejemplo, en respiradores de cartucho, sistemas de recirculación de aire en espacios públicos, venteos de drenajes y plantas de tratamiento de agua, casetas de aplicación de pinturas, espacios que almacenan o aplican solventes orgánicos…)
- Tratamiento de personas con intoxicación aguda (el carbón activado se considera el “antídoto mas universal”, y se aplica en salas de urgencias y hospitales)
- Refinación de azúcar (el carbón retiene las proteínas que dan color al jugo de caña; el objetivo fundamental de este proceso es evitar que el azúcar fermente y se eche a perder)
- Decoloración de aceites vegetales (como el de coco), glucosa de maíz y otros líquidos destinados a la alimentación
- Decoloración y deodorización de bebidas alcohólicas (como vinos de uva y destilados de cualquier origen)
- Recuperación de oro (el oro que no se puede separar de los minerales por los procesos de flotación, se disuelve en cianuro de sodio y se adsorbe en carbón activado)

¿Qué le da al carbón activado la propiedad de adsorber, principalmente moléculas orgánicas?
Cualquier partícula de carbón tiene la capacidad de adsorber. Es por
ello que algunas personas colocan carbón de leña en el refrigerador para
eliminar los olores. Lo mismo sucede si se coloca carbón en un
recipiente con agua: elimina color, sabor y olor. O bien, en el campo,
las personas queman tortilla y la ingieren para aliviarse de problemas
digestivos (como infecciones ligeras, indigestión o flatulencia).
Activar un carbón consiste en hacerlo poroso para ampliar su capacidad de adsorción. Un gramo de carbón de leña tiene un área superficial de alrededor de 50 m2. Con la activación, ésta llega a 600 u 800 m2. Es decir, aumenta entre 12 y 16 veces.
Los átomos de carbono que forman un sólido al que llamamos “carbón”, se ligan entre sí mediante uniones de tipo covalente. Cada átomo comparte un electrón con otros cuatro átomos de carbono (hay que recordar que en las uniones iónicas, el átomo más electronegativo le roba uno o más electrones al otro).
Los átomos que no están en la superficie, distribuyen sus cuatro uniones en todas las direcciones. Pero los átomos superficiales, aunque están ligados con otros cuatro, se ven obligados a hacerlo en menor espacio, y queda en ellos un desequilibrio de fuerzas. Ese desequilibrio es el que los lleva a atrapar una molécula del fluido que rodea al carbón.
La fuerza con la que el átomo superficial de carbono atrapa a la otra, se llama “Fuerza de London”, que es uno de los siete tipos de “fuerzas de Van der Waals”. Se considera una unión fisicoquímica, suficientemente fuerte para retener al adsorbato, pero no tan fuerte como para considerarla una unión química irreversible que forma una nueva estructura molecular. Por ello, la adsorción es reversible y el carbón activado puede reactivarse para utilizarse de nuevo.
Como dijimos, las moléculas que adsorbe el carbón tienden a ser covalentes; no iónicas, pues estas últimas tratarían de robar o de donar electrones a los átomos de carbono. Las uniones entre átomos de carbono e hidrógeno son covalentes, y es por ello que el carbón es un buen adsorbente de moléculas orgánicas.
No todas las moléculas orgánicas tiendan a ser covalentes. Suelen contener átomos de oxígeno, azufre y otros de alta electronegatividad, que dan tendencia iónica a la parte de la molécula que los contiene. Por otro lado, no todas las moléculas inorgánicas tienden a ser iónicas; también las hay de tendencia covalente. Tal es el caso del dicianuro de oro, que hace del carbón activado una parte esencial del proceso de extracción de este metal precioso.
Activar un carbón consiste en hacerlo poroso para ampliar su capacidad de adsorción. Un gramo de carbón de leña tiene un área superficial de alrededor de 50 m2. Con la activación, ésta llega a 600 u 800 m2. Es decir, aumenta entre 12 y 16 veces.
Los átomos de carbono que forman un sólido al que llamamos “carbón”, se ligan entre sí mediante uniones de tipo covalente. Cada átomo comparte un electrón con otros cuatro átomos de carbono (hay que recordar que en las uniones iónicas, el átomo más electronegativo le roba uno o más electrones al otro).
Los átomos que no están en la superficie, distribuyen sus cuatro uniones en todas las direcciones. Pero los átomos superficiales, aunque están ligados con otros cuatro, se ven obligados a hacerlo en menor espacio, y queda en ellos un desequilibrio de fuerzas. Ese desequilibrio es el que los lleva a atrapar una molécula del fluido que rodea al carbón.
La fuerza con la que el átomo superficial de carbono atrapa a la otra, se llama “Fuerza de London”, que es uno de los siete tipos de “fuerzas de Van der Waals”. Se considera una unión fisicoquímica, suficientemente fuerte para retener al adsorbato, pero no tan fuerte como para considerarla una unión química irreversible que forma una nueva estructura molecular. Por ello, la adsorción es reversible y el carbón activado puede reactivarse para utilizarse de nuevo.
Como dijimos, las moléculas que adsorbe el carbón tienden a ser covalentes; no iónicas, pues estas últimas tratarían de robar o de donar electrones a los átomos de carbono. Las uniones entre átomos de carbono e hidrógeno son covalentes, y es por ello que el carbón es un buen adsorbente de moléculas orgánicas.
No todas las moléculas orgánicas tiendan a ser covalentes. Suelen contener átomos de oxígeno, azufre y otros de alta electronegatividad, que dan tendencia iónica a la parte de la molécula que los contiene. Por otro lado, no todas las moléculas inorgánicas tienden a ser iónicas; también las hay de tendencia covalente. Tal es el caso del dicianuro de oro, que hace del carbón activado una parte esencial del proceso de extracción de este metal precioso.
¿A partir de qué materias primas puede obtenerse un carbón activado?
En teoría, podría activarse cualquier partícula de carbón. No
obstante, si el carbón está muy ordenado (como es el caso del diamante o
el grafito), es difícil eliminar algunos átomos de carbono para generar
poros.
Una manera de clasificar carbones, se basa en el grado de “coquización” u ordenamiento de sus átomos de carbono. Mientras menos ordenados, el carbón es menos duro y puede activarse con mayor facilidad.
Las materias primas más utilizadas para fabricar carbón activado son: maderas poco duras (como la de pino), carbones minerales (ligníticos, bituminosos y de antracita) y cáscaras o huesos de vegetales (concha de coco, hueso de aceituna o de durazno, cáscara de nuez).
Los carbones activados fabricados a partir de maderas poco duras, forman poros de diámetro grande, y son particularmente adecuados para decolorar líquidos.
Los que se fabrican a partir de carbones minerales, tienden a formar una amplia gama de poros; suelen ser más adecuados para aplicaciones en las que los compuestos que buscan retenerse son de distintos tamaños moleculares.
Los que parten de cáscaras o huesos duros, forman poros pequeños, y se aplican en el tratamiento de gases o en la potabilización de aguas que provienen de pozos.
Una manera de clasificar carbones, se basa en el grado de “coquización” u ordenamiento de sus átomos de carbono. Mientras menos ordenados, el carbón es menos duro y puede activarse con mayor facilidad.
Las materias primas más utilizadas para fabricar carbón activado son: maderas poco duras (como la de pino), carbones minerales (ligníticos, bituminosos y de antracita) y cáscaras o huesos de vegetales (concha de coco, hueso de aceituna o de durazno, cáscara de nuez).
Los carbones activados fabricados a partir de maderas poco duras, forman poros de diámetro grande, y son particularmente adecuados para decolorar líquidos.
Los que se fabrican a partir de carbones minerales, tienden a formar una amplia gama de poros; suelen ser más adecuados para aplicaciones en las que los compuestos que buscan retenerse son de distintos tamaños moleculares.
Los que parten de cáscaras o huesos duros, forman poros pequeños, y se aplican en el tratamiento de gases o en la potabilización de aguas que provienen de pozos.
¿Qué forma física tiene un carbón activado?
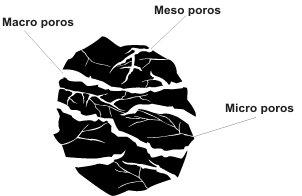
El carbón puede producirse en forma de polvo, de gránulos o de pelets cilíndricos.
El polvo sólo se aplica en la purificación de líquidos; el carbón se dosifica en un tanque con agitación y luego se separa del líquido por medio de un filtro adecuado para retener partículas pequeñas (como es el filtro prensa).
En el caso del carbón granular, se produce en diferentes rangos de partícula, que se especifican con base en la granulometría o número de malla. Una malla 4, por ejemplo, es la que tiene cuatro orificios en cada pulgada lineal. Se aplican, tanto en la purificación de líquidos como de gases.
Los pelets se aplican normalmente en el tratamiento de gases, ya que su forma cilíndrica produce una menor caída de presión.
Para el caso de que se desea un carbón granular o pelet, si la materia prima no es suficientemente dura, se puede reaglomerar con un agente ligante que le imparte dureza para evitar que se rompa al paso del fluido.
El polvo sólo se aplica en la purificación de líquidos; el carbón se dosifica en un tanque con agitación y luego se separa del líquido por medio de un filtro adecuado para retener partículas pequeñas (como es el filtro prensa).
En el caso del carbón granular, se produce en diferentes rangos de partícula, que se especifican con base en la granulometría o número de malla. Una malla 4, por ejemplo, es la que tiene cuatro orificios en cada pulgada lineal. Se aplican, tanto en la purificación de líquidos como de gases.
Los pelets se aplican normalmente en el tratamiento de gases, ya que su forma cilíndrica produce una menor caída de presión.
Para el caso de que se desea un carbón granular o pelet, si la materia prima no es suficientemente dura, se puede reaglomerar con un agente ligante que le imparte dureza para evitar que se rompa al paso del fluido.
¿Cómo se activa un carbón?
El carbón puede activarse mediante procesos térmicos o químicos. Los
procesos térmicos consisten en provocar una oxidación parcial del
carbón, para lograr que se formen los poros, pero evitando que se
gasifique y se pierda más carbón del necesario. Esto ocurre a
temperaturas que están entre los 600 y los 1100 °C, y en una atmósfera
controlada (que se logra mediante la inyección de una cantidad adecuada
de vapor de agua o de nitrógeno).
Los procesos químicos parten de la materia prima antes de carbonizarse. Los reactivos son agentes deshidratantes (como ácido fosfórico) que rompen las uniones que ligan entre sí a las cadenas de celulosa. Después de esta etapa, el material se carboniza a una temperatura relativamente baja (de unos 550 °C) y luego se lava para eliminar los restos de reactivo y de otros subproductos.
Los hornos en los que se activa un carbón térmicamente o en los que se carboniza un carbón previamente tratado con un químico, pueden ser rotatorios o verticales (de etapas).
Los procesos químicos parten de la materia prima antes de carbonizarse. Los reactivos son agentes deshidratantes (como ácido fosfórico) que rompen las uniones que ligan entre sí a las cadenas de celulosa. Después de esta etapa, el material se carboniza a una temperatura relativamente baja (de unos 550 °C) y luego se lava para eliminar los restos de reactivo y de otros subproductos.
Los hornos en los que se activa un carbón térmicamente o en los que se carboniza un carbón previamente tratado con un químico, pueden ser rotatorios o verticales (de etapas).
¿Cuál es la capacidad de adsorción del carbón activado?
La capacidad de un carbón activado para retener una sustancia
determinada no sólo está dada por su área superficial, sino por la
proporción de poros cuyo tamaño sea el adecuado, es decir, un poco
adecuado tiene un diámetro de entre una y cinco veces la molécula de que
se va a adsorber.
Si se cumple esta condición, la capacidad de un carbón activado puede ser de entre el 20% y el 50% de su propio peso.
Si se cumple esta condición, la capacidad de un carbón activado puede ser de entre el 20% y el 50% de su propio peso.
¿Cómo elimina el carbón activado el cloro libre presente en el agua?
La decloración consiste en un mecanismo complicado que puede seguir
distintos caminos de reacción en los que el CA puede intervenir como
reactivo o como catalizador.
El cloro libre puede adicionarse al agua en forma de cloro gas, solución de hipoclorito de sodio, o tabletas -gránulos- de hipoclorito de calcio.
En cualquiera de estos casos, el cloro queda disuelto en forma de ácido hipocloroso (HOCl), un ácido débil que tiende a disociarse parcialmente.
Las distribución entre ácido hipocloroso y ión hipoclorito depende del pH y de la concentración de estas especies. A ambas formas moleculares se les define como cloro libre.
Las dos son fuertes oxidantes que al ser adicionados al agua reaccionan de manera casi inmediata con impurezas orgánicas e inorgánicas, y ejercen un efecto biocida en los microorganismos.
El cloro que reacciona y el que interviene en esta etapa de desinfección, deja de ser libre y queda combinado y deja de ser libre. Una vez terminada esta etapa, es necesario eliminar el cloro libre residual, mediante carbón activado granular.
Cuando el carbón se expone al cloro libre, se llevan a cabo reacciones en las que el HOCl o el OCl- se reducen a ión cloruro. Dicha reducción es el resultado de distintos caminos de reacción posibles.
En dos de los más comunes, el CAG actúa de acuerdo con las siguientes reacciones:
En donde C* representa al carbón activado. C*O y C*O2 son óxidos superficiales, que poco a poco van ocupando espacios que, al quedar bloqueados, ya no participan en la reacción. Algunos de estos óxidos se liberan hacia la solución como CO y CO2. Esto vuelve a dejar espacios disponibles que por lo tanto aumentan la capacidad del CAG para esta reacción.
En cuanto al , también se acumula en la superficie del carbón durante los primeros momentos de operación. Al seguir llegando HOCl o a la superficie del carbón, la reacción se hace un poco más lenta, y entonces se empieza a liberar el . Esta disminución de velocidad se debe al envenenamiento del carbón con los óxidos superficiales. Dicho envenenamiento continúa de manera gradual, mientras disminuye la capacidad, tanto de adsorción como de decloración del CA.
En las reacciones anteriores puede intervenir en lugar de HOCl, con la diferencia que no se produce H+. Puede observarse que el CA reacciona y por lo tanto desaparece. Si no hubiera acumulación de óxidos superficiales, la reacción continuaría hasta la desaparición completa del carbón.
El cloro libre puede adicionarse al agua en forma de cloro gas, solución de hipoclorito de sodio, o tabletas -gránulos- de hipoclorito de calcio.
En cualquiera de estos casos, el cloro queda disuelto en forma de ácido hipocloroso (HOCl), un ácido débil que tiende a disociarse parcialmente.
Las distribución entre ácido hipocloroso y ión hipoclorito depende del pH y de la concentración de estas especies. A ambas formas moleculares se les define como cloro libre.
Las dos son fuertes oxidantes que al ser adicionados al agua reaccionan de manera casi inmediata con impurezas orgánicas e inorgánicas, y ejercen un efecto biocida en los microorganismos.
El cloro que reacciona y el que interviene en esta etapa de desinfección, deja de ser libre y queda combinado y deja de ser libre. Una vez terminada esta etapa, es necesario eliminar el cloro libre residual, mediante carbón activado granular.
Cuando el carbón se expone al cloro libre, se llevan a cabo reacciones en las que el HOCl o el OCl- se reducen a ión cloruro. Dicha reducción es el resultado de distintos caminos de reacción posibles.
En dos de los más comunes, el CAG actúa de acuerdo con las siguientes reacciones:
En donde C* representa al carbón activado. C*O y C*O2 son óxidos superficiales, que poco a poco van ocupando espacios que, al quedar bloqueados, ya no participan en la reacción. Algunos de estos óxidos se liberan hacia la solución como CO y CO2. Esto vuelve a dejar espacios disponibles que por lo tanto aumentan la capacidad del CAG para esta reacción.
En cuanto al , también se acumula en la superficie del carbón durante los primeros momentos de operación. Al seguir llegando HOCl o a la superficie del carbón, la reacción se hace un poco más lenta, y entonces se empieza a liberar el . Esta disminución de velocidad se debe al envenenamiento del carbón con los óxidos superficiales. Dicho envenenamiento continúa de manera gradual, mientras disminuye la capacidad, tanto de adsorción como de decloración del CA.
En las reacciones anteriores puede intervenir en lugar de HOCl, con la diferencia que no se produce H+. Puede observarse que el CA reacciona y por lo tanto desaparece. Si no hubiera acumulación de óxidos superficiales, la reacción continuaría hasta la desaparición completa del carbón.
¿Qué tipo de carbón es el más adecuado para decolorar?
Los colores que se manifiestan en líquidos suelen ser moléculas de
tamaño relativamente grande. Por lo tanto, se adsorben en poros grandes,
lo que hace que los carbones más adecuados para retenerlos sean los de
mayor macroporosidad.
Los carbones de madera, particularmente los de maderas no muy duras (como pino) que se activan químicamente, son los más macroporosos y, por lo tanto, son los más adecuados para decolorar.
El problema de estos carbones es que son poco duros y poco resistentes a la abrasión, lo que obliga a aplicarlos en forma de polvo. Cuando se requiere que el carbón decolorante sea granular, la mejor alternativa suele ser un carbón de lignita. Es el carbón mineral de mayor macroporosidad.
Los carbones de madera, particularmente los de maderas no muy duras (como pino) que se activan químicamente, son los más macroporosos y, por lo tanto, son los más adecuados para decolorar.
El problema de estos carbones es que son poco duros y poco resistentes a la abrasión, lo que obliga a aplicarlos en forma de polvo. Cuando se requiere que el carbón decolorante sea granular, la mejor alternativa suele ser un carbón de lignita. Es el carbón mineral de mayor macroporosidad.
¿Qué tipo de carbón activado es el más adecuado para potabilizar agua?
Los contaminantes típicamente presentes en aguas de pozo suelen ser
de bajo peso molecular y, para estos casos, el carbón más adecuado es
uno de alta microporosidad.
Los carbones que mejor cumplen con esta condición son, en primer lugar, los de concha de coco y, posteriormente, los minerales bituminosos.
Los carbones que mejor cumplen con esta condición son, en primer lugar, los de concha de coco y, posteriormente, los minerales bituminosos.
¿Por qué varía el pH del agua cuando se instala un carbón virgen?
Cuando un carbón se activa químicamente, es impráctico e innecesario
que el fabricante elimine del producto final todo el químico utilizado.
Por lo tanto, si el químico fue un ácido, disminuirá el pH de los
primeros litros de agua que entran en contacto con el carbón. Ocurrirá
lo contrario si el químico utilizado fue un álcali.
En el caso de un carbón activado térmicamente (sin la presencia de otros químicos que no sean vapor de agua y gases de combustión), aumenta el pH de los primeros litros de agua que se trata con el mismo.
Esto se debe a que todos los vegetales tienen cantidades importantes de sodio, potasio, calcio y otros catiónes que, en el proceso de carbonización, permanecen en el carbón en forma de óxidos. Estos óxidos se convierten en hidróxidos al entrar en contacto con el agua, se disuelven en la misma y aumentan su pH.
Cuando no varía el pH de los primeros litros de agua que entran en contacto con un carbón, puede tratarse de un carbón de pH ajustado o de un carbón ultrapuro (libre de solubles).
En el caso de un carbón activado térmicamente (sin la presencia de otros químicos que no sean vapor de agua y gases de combustión), aumenta el pH de los primeros litros de agua que se trata con el mismo.
Esto se debe a que todos los vegetales tienen cantidades importantes de sodio, potasio, calcio y otros catiónes que, en el proceso de carbonización, permanecen en el carbón en forma de óxidos. Estos óxidos se convierten en hidróxidos al entrar en contacto con el agua, se disuelven en la misma y aumentan su pH.
Cuando no varía el pH de los primeros litros de agua que entran en contacto con un carbón, puede tratarse de un carbón de pH ajustado o de un carbón ultrapuro (libre de solubles).
¿Qué tipo de carbón activado es el más adecuado para purificar aire y gases?
Todos los contaminantes en estado gaseoso tienen diámetros
moleculares menores a 2 nm. Esto significa que se adsorben
preferentemente en microporos. Los carbones de concha de coco son los de
mayor microporosidad y, por lo tanto, son los más usados en la
purificación de aire y gases.
Existen los carbones activados de estructura modificada, carbón activado especial, que se utilizan cuando un carbón activado estándar no puede retener otros compuestos no orgánicos.
Existen los carbones activados de estructura modificada, carbón activado especial, que se utilizan cuando un carbón activado estándar no puede retener otros compuestos no orgánicos.
En Carbotecnia somos fabricantes y especialistas de carbón activado.
Puede consultar los diferentes tipos de carbón activado que manejamos aquí.



:)
ResponderEliminar