Proyectos Y MAQUETAS
INFORMACIÓN PARA SELECCIÓN DE MAQUETAS Y PROYECTOS
Temas sugeridos
Ácido cítrico
Ácido pirúvico
 APAMINA
APAMINA

El origen exacto de la apiterapia es difícil de determinar y puede ser rastreado hasta el antiguo Egipto, Grecia y China. La miel y otros productos de abejas se han utilizado desde hace miles de años y sus propiedades curativas se han incluido en varios textos religiosos como los Vedas, la Biblia y el Corán. Estos se han atribuido sobre todo a los beneficios nutricionales del consumo de los productos de las abejas y no al uso del veneno. Existen referencias sobre la apiterapia desde el papiro de Ebers 1700 a. C. en la Torá Pentateuco, en la Biblia, y en los escritos de Aristóteles, Plinio, Discórides, Galeno, Hipócrates, Varrón, Avicena, etc.
Existen relatos como la cura de gota de Carlomagno (748-814) o el dolor articular de Iván el Terrible (1530-1548) con picaduras de abeja.
Un estudio más actual sobre la apiterapia, específicamente del veneno, se inició mediante los esfuerzos del físico australiano Philip Terc, publicados en 1888: “Informe sobre una conexión peculiar entre los piquetes de abeja y el reumatismo” (Report about a Peculiar Connection Between the Bee stings and Rheumatism). Su más reciente popularidad se debe a Charles Mraz, apicultor de Vermont, Estados Unidos (véase también Bodog Beck, M.D.).
En el siglo XX cabe destacar a Filip Terc, reconocido como el padre de la apiterapia, y el doctor Bodog F. Beck quien ya usó la palabra apiterapia para referirse a este tratamiento natural. Posteriormente, Charles Mraz (1905-1999) quien promovió la fundación de la American Apitherapy Society.
El componente activo más abundante del veneno es la melitina (50 por ciento del peso seco del veneno de abejas), la cual tiene acción antiinflamatoria. Sin embargo, el veneno de abeja es una mezcla compleja de varios péptidos y proteínas, algunos de los cuales tienen efectos neurotóxicos e inmunológicos.[cita requerida]
No existe una práctica estandarizada para la administración del veneno de abeja. Algunos sustentan que la localización de la picada es importante, ya que para ellos el aguijón actúa como un tipo de acupuntura en combinación con los efectos del veneno; otros señalan que la localización no es importante. El número de picadas también varía ampliamente, desde unas cuantas hasta cientos y pueden ser administradas por abejas vivas o por inyecciones. Recientemente se ha logrado la extracción del veneno de abejas en el laboratorio, lo que vuelve más segura la aplicación mediante el control de la dosificación, del sitio de aplicación y con un menor riesgo de infecciones.[cita requerida]
La fase I de un estudio realizado en el centro médico de la Universidad de Georgetown, en Washington, DC, financiado por la Asociación de Esclerosis Múltiple de América (MSAA, por sus siglas en inglés), se diseñó para determinar la seguridad en la administración de tratamientos del veneno de abeja en los seres humanos con esclerosis múltiple.
Otros estudios preclínicos y clínicos han comenzado a construir la evidencia científica en torno al uso de los productos de la colmena como tratamiento para enfermedades.[cita requerida]
 El etileno se comporta de la
misma manera que las hormonas en los mamíferos y desencadena eventos
específicos durante el curso natural de crecimiento y desarrollo.
El etileno se comporta de la
misma manera que las hormonas en los mamíferos y desencadena eventos
específicos durante el curso natural de crecimiento y desarrollo.
 © Getty Images
© Getty Images

TEMA 4


IEMA 6
ACEITE DE BARBASCO.
En los inicios del siglo XXI, el consumidor comenzó a preocuparse por la inocuidad de los alimentos que consumía. Lo último dicho abarcaba la calidad de los alimentos, los fertilizantes que se utilizaban, cuán propicio era la tierra que se utilizaba entre otros detalles que le generaban valor agregado a los alimentos en el mercado internacional. Por ello, este pensamiento ecológico, que no tan sólo abarca la siembra, la cosecha y la comercialización de los alimentos, sino también de técnicas amigables con el medio ambiente, le abrió la puerta al Perú para trabajar en una agricultura orgánica.
Esta nueva corriente del cuidado de la salud y el medio ambiente en Europa, Estados Unidos y Japón, han generado la posibilidad de que las exportaciones peruanas de productos orgánicos se incrementen en los últimos años. A su vez, genere trabajo y desarrollo a un mayor número de regiones a nivel nacional. Para la práctica de una agricultura orgánica, se comenzaron a utilizar fertilizantes biodegradables, inofensivos para el ecosistema. Este nuevo tipo de fertilizantes tienen en su composición, heces de animales y, en otros casos, compuestos por diversidad de plantas que juntas favorecen a una mejor calidad de suelo para tener óptimas cosechas. Entre estos fertilizantes, encontramos el barbasco en polvo, que contiene una sustancia llamada Rotenona, la cual es muy útil para el agro y la ganadería. El presente trabajo es dedicado a la exploracion del barbasco, tomando en cuenta algunos puntos importantes para su estudio y uso, como por ejemplo, Generalidades, Modo de acción, usos y precauciones, etc.
TEMA 7
INSECTICIDA ABASE DE AJI Y BARBASCO
http://marthali-abonosorganicos.blogspot.com/2011/08/insecticida-de-aji-y-barbasco.html
TEMA 8
Bioestimuladores de Crecimiento




PARA PROPONER PROYECTOS DE QUÍMICA
ORGÁNICA
- . TEMA
- . OBJETIVOS
- . SUSTENTO CIENTIFICO E HIPOTEIS PROPUESTA
- . MAQUETA, EXPLICACIÓN, DEMOSTRACION
- . CONCLUSIONES
- BIBLIOGRAFIA(normas apa)
Su informe se trabajará
en formato tríptico. Plazo entrega, semana del 2 al 5 de mayo.
Temas sugeridos
Ácido cítrico
 |
||
| Nombre IUPAC | ||
| Ácido 3-hidroxicarboxi pentanodióico | ||
| General | ||
| Otros nombres | Ácido cítrico | |
| Fórmula estructural | 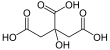 |
|
| Fórmula molecular | C6H8O7 | |
| Identificadores | ||
| Número CAS | 77-92-91 | |
| Número RTECS | GE7350000 | |
| ChEBI | 30769 | |
| ChemSpider | 305 | |
| DrugBank | 04272 | |
| PubChem | 311 | |
| Propiedades físicas | ||
| Densidad | 1665 kg/m3; 1,665 g/cm3 | |
| Masa molar | 192,13 g/mol | |
| Punto de fusión | 448 K (175 °C) | |
| Propiedades químicas | ||
| Acidez | 1=3,15; 2=4,77; 3=6,40 pKa | |
| Solubilidad en agua | 133 g/100 ml (22 °C) | |
| Riesgos | ||
| Riesgos principales | Irrita piel y ojos. | |
| Valores en el SI y en condiciones estándar (25 °C y 1 atm), salvo que se indique lo contrario. |
||
| [editar datos en Wikidata] | ||
Ácido pirúvico
 |
||
| Nombre IUPAC | ||
| Ácido oxopropanoico | ||
| General | ||
| Otros nombres | Ácido pirúvico, ácido α-cetopropanoico |
|
| Fórmula semidesarrollada | H3C-CO-COOH | |
| Fórmula estructural | Ver imagen: gris=carbono, rojo=oxígeno, blanco=hidrógeno. | |
| Fórmula molecular | C3H4O3 | |
| Identificadores | ||
| Número CAS | 127-17-31 | |
| ChEBI | 32816 | |
| ChemSpider | 1031 | |
| DrugBank | 00119 | |
| PubChem | 1060 | |
| Propiedades físicas | ||
| Apariencia | Incoloro | |
| Densidad | 1.250 kg/m3; 1.25 g/cm3 | |
| Masa molar | 88,06 g/mol | |
| Punto de fusión | 285 K (12 °C) | |
| Punto de ebullición | 438 K (165 °C) | |
| Peligrosidad | ||
| Punto de inflamabilidad | 355 K (82 °C) | |
| Temperatura de autoignición | 578 K (305 °C) | |
| Compuestos relacionados | ||
| Ácidos relacionados | Ácido láctico | |
| Valores en el SI y en condiciones estándar (25 °C y 1 atm), salvo que se indique lo contrario. |
||
| [editar datos en Wikidata] | ||
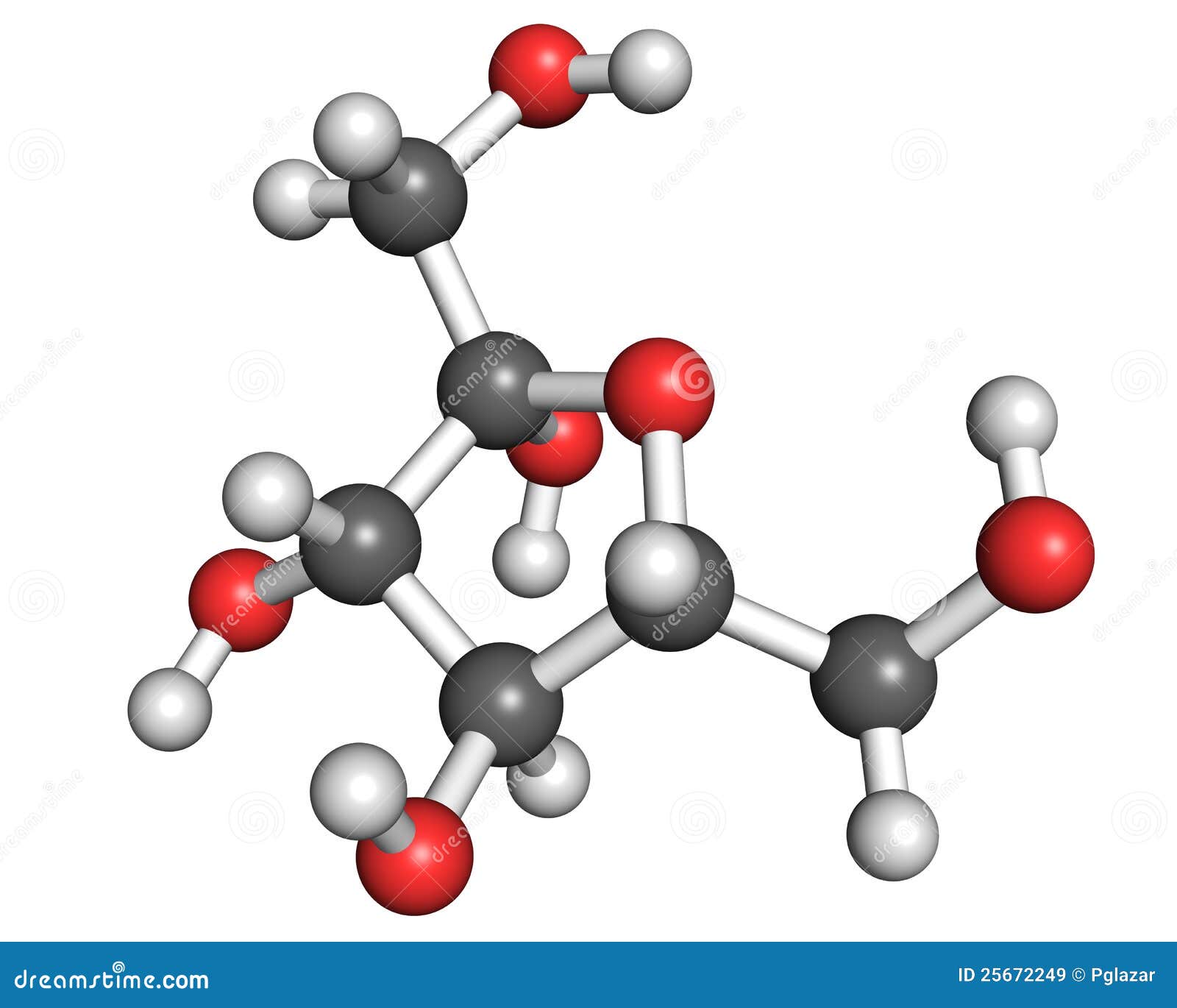
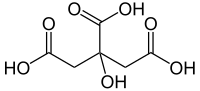
Ácido tartárico
Descripción y generalidades
El ácido tartárico
es un compuesto orgánico polifuncional, cuyo grupo funcional principal
es el carboxilo. Por lo tanto, contiene dos grupos carboxílicos y dos
grupos de alcohol en una cadena de hidrocarburo lineal de longitud
cuatro. El ácido tartárico es considerado un ácido débil.
Este
ácido tartárico está presente en muchas plantas y en la tierra, ya era
conocido por los romanos y por los griegos. Principalmente, se encuentra
en la uva en forma libre y combinada. Siendo así, uno de los
componentes característicos y distintivos de esta fruta.
El ácido tartárico fue aislado por primera vez en el año de 1769, por el químico sueco Carl Wilhelm Scheele.
El ácido tartárico se presenta como un polvo blanco cristalino, de sabor fuertemente ácido, inodoro y estable a la luz y al aire.
Actualmente,
el ácido tartárico lo podemos obtener por medio de los subproductos de
la uva, las materias primas utilizadas en su fabricación son residuos
naturales de la vinificación exclusivamente. (Las cáscaras de uva).
Fórmula química del ácido tartárico: H2C4H4O6
Otros nombres
Crema tártara o ácido tártricoPresentaciones
Este producto está disponible en la siguiente presentación:- Saco 25 kg
Usos y aplicaciones
Principalmente, el ácido tartárico es empleado en la industria alimentaria, allí tiene los siguientes usos y aplicaciones:

- Como acidificante
- Emulsionante en panaderías
- Como conservante natural
- Ingrediente para levadura, bizcocho, mermelada, gelatina, bebidas gaseosas y caramelo
- Como efervescente
- Condimento
- Regulador de antioxidante, acidez, agente leudante y secuestrante.
En general, el ácido tartárico está presente en los siguientes productos:
- Caramelos
- Pastillas, gomas de mascar y gomitas
- Chocolates
- Galletas dulces
- Bebidas con gas
- Pasteles, pastas y otros productos de panificación
- Vinos
También el ácido tartárico tiene usos y aplicaciones en las siguientes industrias:
- Industria farmacéutica. Se utiliza para la elaboración de antibióticos, pastillas y píldoras efervescentes, compuestos terapéuticos y medicina para las cardiopatías.
- Industria química. Se utiliza en la fotografía, en la industria electrónica, en la galvanotecnia, como antioxidante para las grasas industriales y como secuestrante de iónes metálicos.
- Industria de la construcción. Retardante del fraguado del yeso, escayola y el cemento.
- Industria ecológica. Utilizado como acidificante.

Importante
En Pochteca Materias Primas contamos con ingredientes y Aditivos alimentarios para la industria como el ácido tartárico, el cual podrá encontrar en diferentes presentaciones.
¡Consulte más información aquí!
Pochteca Alimentos
¡Consulte más información aquí!
Pochteca Alimentos
Fuentes
Ácido hialurónico
Study of hyaluronic acid capture by Ascaris lumbricoides
Patricia Ponce de León1 *, Patricia Foresto2 **, Juana Valverde2 **
1. Bioquímica
2. Doctora en Ciencias Bioquímicas
* Laboratorio de Parasitología. Facultad de Cs. Bioquímicas y Farmacéuticas. UNR. Santa Fe. Argentina.
** Laboratorio de Inmunohematología, Hemorrelogía e Inmunogenética. Facultad de Cs. Bioquímicas y Farmacéuticas. UNR. Santa Fe. Argentina.
Resumen
El ácido hialurónico (AH) tiene importantes funciones en la inmunidad. En experiencias previas se demostró que extractos de adultos de A. lumbricoides y concentrados larvarios, tienen capacidad de unión a AH. El objetivo de este trabajo fue estudiar la captación de AH por este helminto. Se trabajó con tres extractos del parásito adulto ([EA]B,C,D) y 3 concentrados de larvas ([CLAL1]: 1100 a 1200 larvas/ mL; [CLAL2]: 400 a 600 larvas/ mL y [CLAL3]: 100 a 200 larvas/ mL). Se empleó la técnica modificada de Inhibición de la Adhesión para detección del Receptor CD44 soluble de hialuronato en suero humano. Se definió CexpAdhEAH como el cociente entre los eritrocitos adheridos por el AH en presencia y ausencia del parásito y se definió IexpCPAH, como la cantidad de eritrocitos que se dejaron de adherir debido a la captación de AH por el parásito, referido al número total de eritrocitos. Los resultados mostraron diferencias significativas en CexpAdhEAH y en IexpCPAH, por efecto de la concentración larvaria y del [EA]. Las medias aritméticas de CexpAdhEAH y de IexpCPAH para los concentrados larvarios fueron 0,636 y 0,21 ([CLAL1]); 0,819 y 0,068 ([CLAL2]); 0,97 y 0,013 ([CLAL3]). Las medianas de CexpAdhEAH y de IexpCPAH para los extractos fueron [EA]C 0,275 y 0,4; [EA]B: 0,20 y 0,43; [EA]D: 0,075 y 0,495. La experiencia permitiría suponer que el parásito puede captar AH para interferir en la respuesta inmune del hospedador.
Palabras clave: Ascaris lumbricoides; Ácido hialurónico; Captación
Summary
Hyaluronan Acid (HA) has important functions in immunity. Previous experiences have shown that A. lumbricoides’s extracts of adult specimens and larval concentrates have hyaluronan binding capacity. The aim of this study was to analyse the HA capture by this helminth. Three extracts of adult specimens ([AE]B,C,D) and 3 larval concentrates ([ALLC1]: 1100 to 1200 larvae/ mL; [ALLC2]: 400 to 600 larvae/ mL and [ALLC3]: 100 to 200 larvae/ mL) were studied. The modified test of serum soluble CD44 Detection by Aggregation Inhibition was used. CexpAdhEAH was defined as the quotient between erythrocytes adhered by the HA in presence and in absence of the parasite, and IexpCPAH was defined as the amount of erythrocytes that stopped adhering due to the HA capture by the parasite in relation to the total number of erythrocytes. The results showed significant differences in CexpAdhEAH and IexpCPAH as the result of larvae concentration and of the extracts. The arithmetic means of CexpAdhEAH and IexpCPAH for the larvae were 0.636 and 0.21 ([ALLC1]); 0.819 and 0.068 ([ALLC2]); 0.97 and 0.013 ([ALLC3]). Medians of CexpAdhEAH and IexpCPAH for the extracts were [EA]C:0.275 and 0.4; [EA]B: 0.20 and 0.43; [EA]D: 0.075 and 0.495. From the experience, it could be assumed that the parasite can capture the HA to interfere in the host’s immune response.
Keywords: Ascaris lumbricoides; Hyaluronic acid; Capture
Introducción
El ácido hialurónico (AH) es un glicosaminoglicano constituido por residuos alternantes de ácido glucurónico y N-acetilglucosamina. No tiene una forma definida en el espacio, sino que se extiende aleatoriamente tendiendo a ocupar un volumen muy grande debido a la repulsión electrostática de los grupos carboxilo del ácido urónico (1).
El AH no sólo representa el componente fundamental de la matriz extracelular de diversos órganos, tejidos, y articulaciones (2), sino que también participa activamente en su estabilización. El Inter –Alfa –Inhibidor (IAI) es un complejo proteico sanguíneo con actividad antiinflamatoria formado por una cadena liviana de bikunina (ITIL) y dos cadenas pesadas de interinhibidor (ITIHs). Tiene actividad anti-proteasa y por eso ejerce efectos anti-inflamatorios bloqueando la actividad biológica de enzimas plasmáticas, así como las liberadas por inmunocitos tipo neutrofilos. ITIHs pueden ser transferidas desde el IAI a moléculas de AH para unirse covalentemente y formar complejos AH-ITIHs en la matriz extracelular que aseguran su estabilidad (3)
El AH tiene también un rol importante en la respuesta inmune. Es el constituyente principal del tejido conjuntivo, que es una de las barreras mecánicas naturales (4). Su viscosidad ayuda a prevenir el pasaje de virus y bacterias por la zona pericelular (5)(6). Es un reconocido estimulador del proceso inflamatorio que tiene propiedades antioxidantes, capacidad para eliminar radicales libres y actúa como barrera de degradación tisular (7-9). Asimismo, puede activar células dendríticas por TLR4 (Receptor Símil Toll 4) (10) y es ligando de moléculas de adhesión fundamentales en la respuesta inmune (11).
Se ha comunicado que a pesar de que los mecanismos celulares de muchos procesos infecciosos no se conocen con exactitud, podrían involucrar a los glicoconjugados del parásito y del hospedador (12).
Debido al amplio espectro de funciones biológicas del AH y a las múltiples estrategias de evasión parasitaria de la respuesta inmune, en experiencias previas se investigó si extractos preparados a partir de la cutícula de ejemplares adultos de A. lumbricoides podían unir AH. Los resultados demostraron que el 63,89% de los 36 extractos estudiados tenían capacidad de unión a AH, indicando la existencia de un receptor en el nematodo con capacidad de unión a este heteropolisacárido (13).
Como la quitina es otro polisacárido, indispensable para el desarrollo de las cubiertas de los helmintos, y se ha demostrado similitud entre los mecanismos biosintéticos de AH y de quitina (14), se consideró la posibilidad de que los receptores para quitina fueran los que captaban AH. Por ese motivo, se realizaron experiencias con larvas de A. lumbricoides, ya que carecen de quitina, donde se demostró que los estadios larvales también tienen capacidad de unión de AH (15).
Las investigaciones realizadas demuestran que A. lumbricoides capta AH, lo que sugeriría una competencia entre los receptores del parásito y el hospedador por la unión a este ligando. El objetivo de esta experiencia fue estudiar la captación de AH por este nematodo.
Materiales y Métodos
MUESTRAS
Extractos de A. lumbricoides ([EA]): Se trabajó con tres extractos parasitarios ([EA] B, [EA] C y [EA] D) obtenidos a partir de la remoción de la cutícula de ejemplares adultos y ruptura mecánica refrigerada (16). Los [EA] fueron seleccionados porque habían unido AH en las experiencias previas (13).
Concentrados de larvas ([CLAL]): Se utilizaron 3 concentrados de larvas (L1/ L2) obtenidos de la embrionación in vitro (17) y posterior eclosión de huevos de A. lumbricoides (18). Las larvas fueron recolectadas a 37 ºC por el método de Baermann-Moraes (19) en buffer fosfato. Completada la recolección fueron concentradas por centrifugación y se procedió al recuento de las mismas: [CLAL1] tenía 1100 a 1200 larvas/mL; [CLAL2] 400 a 600 larvas / mL y [CLAL3] 100 a 200 larvas / mL.
MÉTODO
El método empleado fue una modificación de la técnica de Inhibición de la Agregación por Adhesión para detección del Receptor CD44 soluble de hialuronato en suero humano (20).
Para ello se utilizó una suspensión al 2% de eritrocitos Grupo O en medio enzimático de bromelina (15 min a 37 ºC), que es el mismo sistema revelador descrito por la técnica original (20). Se separó el plasma autólogo (PA) correspondiente a dichos hematíes.
Se preparó una suspensión de AH 1/128 (20) y una suspensión en partes iguales de AH 1/64 y [CLAL] o [EA], según correspondió (13)(15), que se dejó en contacto 30 minutos a 4 ºC, a los fines de hacer posible la unión del ácido hialurónico con el extracto parasitario o las larvas.
A continuación se prepararon 3 tubos y se dejaron 1 hora a 4 ºC.
El conteo del Tubo 1 correspondió al Total de células libres (T). Los Tubos 2 (AH 1/128) y 3 (AH-[CLAL]/ [EA]), permitieron la visualización microscópica de los eritrocitos adheridos por agregación por efecto del AH, y en ellos se contaron solamente los hematíes libres. Los conteos de ambos tubos indicaron el número de glóbulos que no fueron adheridos en las condiciones experimentales. Todos los conteos se hicieron por duplicado y se consideró el valor promedio.
En el Tubo 2 (donde se colocó AH) el valor esperado de eritrocitos libres debía ser menor que en el Tubo 3 (donde se agregó la mezcla AH- [CLAL] / [EA]), pues la captación de AH por el parásito dejaría una menor cantidad de AH libre, lo que se traduciría en una menor adhesión eritrocitaria y un mayor número de células rojas libres.
La diferencia de conteo de células libres del Tubo 1 con respecto a los Tubos 2 y 3, indicó la cantidad de eritrocitos que se adhirieron por agregación en ambos casos.
Se define el Índice Experimental de Captación parasitaria de AH como la cantidad de eritrocitos que se dejaron de adherir porque el parásito captó AH, referido al número total de eritrocitos, en las condiciones experimentales definidas. Este índice es una medida del consumo de AH por el parásito, en las condiciones experimentales establecidas, y se expresa como la cantidad de eritrocitos que se dejaron de adherir por acción del parásito en relación a la cantidad total de glóbulos rojos.
ANÁLISIS ESTADÍSTICOS
Para el análisis de ambas variables (CexpAdhEAH e IexpCPAH) empleando los concentrados larvarios, se utilizó un análisis de la variancia a un criterio de clasificación y las comparaciones múltiples de Tukey, debido a que se verificó el cumplimiento de los supuestos exigidos por la técnica estadística (21).
Para el estudio del efecto de los distintos [EA] en ambas variables (CexpAdhEAH e IexpCPAH) se utilizó la prueba de Kruskal-Wallis y las comparaciones múltiples de Dunn (21).
Resultados
[CLAL1] (1000 a 1200 larvas / mL)
Se hicieron las experiencias de captación de AH por las larvas utilizando 10 suspensiones globulares.
Los valores de CexpAdhEAH indicaron que después de que las larvas captaron AH (Tubo 3), el remanente de este heteropolisacárido sólo pudo adherir el 64% de los eritrocitos que se habían adherido en ausencia del parásito en las mismas condiciones experimentales (Tubo 2). La media aritmética de CexpAdhEAH fue 0,636 con una desviación estándar de 0,0675278.
En las condiciones experimentales definidas, los valores obtenidos de IexpCPAH indicaron que las larvas captaron el AH necesario para adherir alrededor del 21% de los eritrocitos totales, siendo la media aritmética 0,211 y la desviación estandar 0,0268535. Los resultados se muestran en la Tabla I.
El estudio de la captación de AH por las larvas se realizó con 13 suspensiones globulares.
Los valores de CexpAdhEAH fueron, tal como se esperaba, más altos que en el caso anterior pues la concentración de larvas era menor y por lo tanto también más baja la cantidad de AH captado por ellas. El rango de los valores de CexpAdhEAH estuvo comprendido entre 0,70 y 0,91 con una media aritmética de 0,819231 y una desviación estándar de 0,06788.
En las condiciones experimentales definidas en el Tubo 3 se adhirieron por agregación aproximadamente el 82% de los eritrocitos adheridos en ausencia del parásito (Tubo 2).
La concentración de larvas de [CLAL2] captó el AH necesario para adherir un valor = al 10% de los eritrocitos totales (la media de los valores de IexpC PAH fue 0,0684615 y la desviación estándar 0,0199358)
Los resultados se muestran en la Tabla I.
[CLAL3] (100 a 200 larvas / mL)
Se calcularon los valores de CexpAdhE AH correspondientes a 4 suspensiones globulares para [CLAL3]. Se observó que los coeficientes fueron = 0,96, indicando que el consumo de AH por las larvas, era muy pequeño, tal como se esperaba debido a la concentración larvaria utilizada. Los eritrocitos adheridos en el Tubo 3 (mezcla AH- [CLAL3]) fueron el 96-98% de los que se habían adherido en el Tubo 2 (AH). La media aritmética de los valores de CexpAdhE AH fue 0,9725 con una desviación estándar de 0,00957427.
Los valores del IexpCPAH indicaron que esta concentración de larvas sólo captaba el AH necesario para adherir aproximadamente el 1% de los eritrocitos totales (la media aritmética fue 0,01325 y la desviación estándar 0,00485627).
Los resultados se muestran en la Tabla I.
ANÁLISIS ESTADÍSTICO
Se concluye que existen diferencias significativas en CexpAdhEAH por efecto de la concentración de larvas (p<0,0001).
Los valores promedios de CexpAdhEAH para [CLAL1] son significativamente menores que los correspondientes a los otros dos concentrados larvales. El promedio para [CLAL2] es además significativamente menor que para [CLAL3] (p<0,01).
Se concluye que existen diferencias significativas en el promedio de IexpCPAH por efecto de la concentración de larvas (p<0,0001).
Los valores promedios del IexpCPAH para la mayor concentración larvaria son significativamente mayores que los correspondientes a las otras dos concentraciones de larvas, así como también el promedio para la concentración de 400 a 600 larvas /mL es significativamente mayor que para la concentración de 100 a 200 larvas /mL (p<0,01).
En experiencias preliminares, se aplicó la técnica de Inhibición de la Agregación por Adhesión para detección del Receptor CD44 soluble de hialuronato en suero humano y se demostró que los tres tenían capacidad de unión de AH.
Los valores de CexpAdhEAH obtenidos mostraron que el [EA] C dejó un remanente de AH después de la captación, que adhería aproximadamente el 28% de los eritrocitos que se habían adherido en ausencia del extracto (el valor de la mediana fue 0,275 y el rango intercuartil 0,05). El AH remanente después del contacto con el [EA] B y con el [EA] D adhirió el 20% de los eritrocitos adheridos en el Tubo 2 (mediana 0,2 y rango intercuartil 0,04) y el 7-8% (mediana 0,075 y rango intercuartil 0,06) respectivamente.
Estos coeficientes indicaron que el [EA] D era el que tenía mayor capacidad de unión a AH.
Los valores de la mediana y el rango intercuartil de IexpCPAH fueron 0,4 y 0,07 para [EA] C; 0,43 y 0,04 para [EA] B; 0,495 y 0,06 para [EA] D.
Los resultados se muestran en la Tabla II.
Se concluye que existen diferencias significativas en el CexpAdhEAH por efecto del extracto parasitario (p<0,0001).
Los valores de CexpAdhEAH para [EA]C son significativamente mayores que los correspondientes a los otros dos, siendo además para el [EA] B significativamente mayores que para el [EA] D (p<0,05).
Se concluye que existen diferencias significativas en el IexpCPAH por efecto del extracto parasitario (p<0,0001).
Los valores de IexpCPAH para [EA] D son significativamente mayores que para los otros dos extractos cuyos valores no difieren entre sí (p<0,05).
Discusión y Conclusiones
El AH participa en varias etapas de la respuesta inmune. En la resistencia natural, para impedir la penetración de gérmenes, participan las barreras mecánicas formadas por la piel, las mucosas (muchas con un epitelio ciliado o vibrátil y el manto de moco que las recubre) y las secreciones, que actúan a modo de lavado y arrastre. Otras defensas más profundas son las diferentes fascias y aponeurosis, y sobre todo, la especial constitución del tejido conjuntivo a manera de espesa malla de ácido hialurónico (4). El AH es simultáneamente componente y estabilizador de la matriz extracelular, con propiedades hidrofílicas, y desempeña un rol importantísimo de génesis, mantenimiento y resolución de la inflamación en la respuesta innata (3).
Por otro lado, se ha comunicado que el AH puede activar células dendríticas a través del TLR4 (Receptor Toll 4) (10). Los TLR son los receptores principalmente involucrados en la activación a nivel intestinal. Si bien las experiencias realizadas indicarían que los TLR no participarían en el reconocimiento de helmintos, tampoco se ha determinado claramente cuál sería el receptor involucrado (22).
Los hialuronatos son componentes sacáridos ligandos de importantes hialuroadherinas y moléculas de adhesión. Entre las primeras se encuentra TSG6 (factor estimulador de necrosis tumoral gen 6) que es una proteína soluble. El grupo de moléculas de adhesión que son receptores de AH, tiene dos miembros, ambos codificados por el gen ras: el CD44 (también denominado Pgp-1, H-CAM, GP90 o HER-MES) y el RHAMM (receptor para la motilidad mediada por hialuronato) (11). CD44 es una glicoproteína transmembrana relacionada con la interacción entre células y matriz extracelular, se expresa en leucocitos, células epiteliales, células gliales, fibroblastos y células musculares. Se la considera una molécula de adhesión, con acción quimiotáctica para linfocitos en el tejido linfoide de las mucosas (placas de Peyer), además se la relaciona a activación leucocitaria, linfopoyesis y metástasis tumoral (11). La proteína RHAMM activa un mecanismo locomotor que permite la adhesión entre las células por inducción transitoria de la fosforilación de la proteína tirosina al comportarse como una tirosina quinasa. Se expresa en la mayoría de linfocitos B periféricos y se cree que está relacionada a su activación (11). La adhesión de AH a RHAMM induce la quimiotaxis y a CD44 se cree que actuaría como una ruta de recaptación para la degradación lisosomal (3).
Experiencias previas han demostrado que los extractos de la cutícula del parásito adulto y los estadios larvales de A. lumbricoides tienen receptores que unen AH (13)(15). En el parásito adulto, esta unión podría deberse a la presencia de uno o más tipos de receptores, pero se desconoce hasta el momento si este receptor es específico para AH, o es un receptor para quitina, o si existen ambos que en forma simultánea pueden realizar la captación (13).
Los resultados obtenidos al estudiar la captación de AH por los concentrados larvales demostraron claramente que a mayor cantidad de larvas, mayor es la cantidad de AH secuestrado por ellas. En las condiciones experimentales definidas, la mezcla AH-[CLAL1] (1000-1200 larvas/mL) dejó un remanente de AH que adhirió el 64% de los eritrocitos que se habían adherido en ausencia de larvas y la mezcla AH-[CLAL2] (400-600 larvas/mL) dejó libre una cantidad de AH como para adherir el 82% de los hematíes que se habían agregado en el Tubo 2. La mezcla AH-[CLAL3] (100-200 larvas/mL) captó tan poca cantidad de AH, que se adhirieron la casi totalidad de los eritrocitos adheridos cuando las larvas no estaban presentes.
Los análisis estadísticos concluyeron que existen diferencias significativas en el valor de CexpAdhEAH por efecto de la concentración de larvas.
El valor del IexpCPAH también demostró que el consumo de AH por las larvas se relaciona en forma directa con la concentración larvaria, pues los resultados del análisis estadístico permitieron concluir que existen diferencias significativas en el promedio de IexpCPAH por efecto de la concentración de larvas.
Se observó que si bien concentraciones tan bajas como las de [CLAL3] captan el AH necesario para adherir el 1% de los eritrocitos totales de la experiencia, [CLAL2] y [CLAL1] pueden captar el AH que adhiere el 7% y 21%, respectivamente, de las células rojas totales. Estos resultados demostraron que el secuestro de AH por el parásito durante la infección, podría tener un valor significativo dependiendo de la concentración de larvas circulantes.
La técnica de Inhibición de la Agregación por Adhesión para detección del Receptor CD44 soluble de hialuronato en suero humano, utiliza dos series de diluciones de un suero (con alto título de CD44 soluble) donde se agrega AH en la primera serie y AH- [EA]/[CLAL] en la segunda. Se revela con eritrocitos Grupo O y se determina el título de CD44 soluble en ambas series. Se considera significativa una diferencia de dos o más diluciones entre los títulos de las dos series (14)(15). Cuando se aplicó esta metodología con los [EA]B,C,D, se observó que la diferencia de título era de 2 diluciones con el [EA]C, 3 con el [EA]B, y 5 diluciones con el [EA]D, lo que indicó que este último extracto era el que más AH captaba. En estas experiencias, los valores hallados de CexpAdh EAH se correlacionaron con los observados previamente, ya que [EA]D dejó un remanente de AH como para adherir solamente el 8% de los eritrocitos adheridos en el Tubo 2, el [EA]B el 20% y el [EA]C un remanente de AH como para adherir el 28% de los hematíes adheridos en ausencia de extracto. El análisis estadístico concluyó que existen diferencias significativas en el valor de CexpAdhEAH por efecto del extracto parasitario.
Los valores de IexpCPAH demostraron que los [EA] captan el AH necesario para adherir entre un 40-50% de los eritrocitos totales, indicando que la acción del parásito adulto en la captación podría ser más relevante que en los estadíos larvales. El análisis estadístico demostró que el valor de IexpCPAH obtenido con el [EA]D tiene una diferencia significativa con los valores obtenidos de este índice con los otros dos extractos.
Si se considera la importancia de las funciones biológicas del AH, los resultados obtenidos con esta experiencia permitirían especular que el parásito lo capta para interferir en el desarrollo de la respuesta inmune del hospedador. Esta captación puede constituir una estrategia de evasión.
CORRESPONDENCIA
DRA. PATRICIA PONCE DE LEÓN
Laboratorio de Parasitología. Dpto. de Microbiología
Facultad de Cs. Bioquímicas y Farmacéuticas
Suipacha 531
2000 ROSARIO, Santa Fe, Argentina
E-mail: tefu1958@hotmail.com
Referencias bibliográficas
1. Battaner Arias E. Universidad de Salamanca, Dpto de Bioquímica y Biología Molecular. Modelos Moleculares 2: Hidratos de Carbono. Disponible en: http://www.usal.es/~dbbm/modmol/modmol02/mm02t01.htm [Fecha de acceso: 2 de agosto de 2009]. [ Links ]
2. Longaker MT, Chiu ES, Adzick NSm, Stern M, Harrison MR, Stern R. Studies in fetal wound healing. A prolonged presence of hyaluronic acid characterizes fetal wound fluid. Ann Surg 1991; 213: 292-6. [ Links ]
3. García G, Hernández S, Mejía O, Baez S, García A. Biología y patobiología humana del ácido hialurónico en la estabilización de la matriz extracelular y la inflamación. Rev Med 2006; 14 (1): 80-7. [ Links ]
4. Bondia García-Puente M. Gran Enciclopedia Rialp: Humanidades y Ciencia. Madrid: Ediciones Rialp SA; 1991. [ Links ]
5. Chen WYJ, Abatangelo G. Functions of hyaluronan in wound repair. Wound Rep Reg 1999; 7: 79-89. [ Links ]
6. Knudson CB, Knudson W. Hyaluronan-binding proteins in development, tissue homeostasis, and disease. FASEB J 1993; 7: 1233-41. [ Links ]
7. Cortivo R, Brun P, Cardarelli L, O’regan M, Conconi Mt, Radice M, et al. Antioxidant effects of hyaluronan and its alpha-methyl-prednisolone derivative in chrondrocyte and cartilage cultures. Sem Arthritis Rheum 1996; 26: 492-501. [ Links ]
8. Nitzan DW, Nitzan U, Dan P, Yedgar S. The role of hyaluronic acid in protecting surface-active phospholipids from lysis by exogenous phospholipase A(2) Rheumatology 2001; 40: 336-40. [ Links ]
9. Presti D, Scott JE. Hyaluronan-mediated protective effect against cell damage caused by enzymatically produced hydroxyl (OH) radical is dependent on hyaluronan molecular mass. Cell Biochem Funct 1994; 12: 281-8. [ Links ]
10. Takeda K, Kaisho T, Akira S. Toll-Like Receptors. Ann Rev Immunol 2003; 21: 335-76. [ Links ]
11. Sanguineti AC, Rodriguez-Tafur JM. Moleculas de Adhesión y Piel. Dermatol Peruana 1999; 9(1). Disponible en: http://www.sisbib.unmsm.edu.pe/Bvrevistas/dermatología/v09_sup1/moléculas.htm [Fecha de acceso: 2 de agosto de 2009]. [ Links ]
12. Souto Padron T. The surface charge of trypanosomatids. An Acad Bras Ciênc 2002; 74 (4): 649-75. [ Links ]
13. Ponce de León P, Foresto P, Valverde J. Ascaris lumbricoides: Capacidad de unión a Hialuronato Acta Bioquím Clín Latinoam 2007; 41(4): 519-24. [ Links ]
14. Takeo S, Fujise M, Akiyama T, Habuchi H, Itano N, Matsuo T, et al. In vivo hyaluronan synthesis upon expression of the mammalian hyaluronan cintasa gene in Drosophila. J Biol Chem 2004; 279: 18920-5. [ Links ]
15. Ponce de León P, Foresto P, Valverde J. Estados larvales de Ascaris lumbricoides: capacidad de unión a ácido hialurónico. Rev Invest Clín 2008; 50: 5-12. [ Links ]
16. Ponce de León P, Valverde J, Zdero M. Preliminary studies on antigenic mimicry of Ascaris lumbricoides. Rev Inst Med Trop S Paulo 2000; 42: 295-6. [ Links ]
17. Fairbairn D. The in vitro hatching of Ascaris lumbricoides eggs. Canad J Zool 1961; 39: 153-62. [ Links ]
18. Geenen PL, Bresciani JB, Pedersen A, Eirksen H, Fagerholm PN. The morphogenesis of Ascaris suum to the infective third-stage larvae within the egg. J Parasitol 1999; 85 (4): 616-22. [ Links ]
19. Shore García L, Ash L. Diagnóstico parasitológico. 2ª Ed. Buenos Aires: Médica Panamericana; 1983. [ Links ]
20. D’Arrigo M. Incidencia de la relación estructura- función del Sistema de Grupo Sanguíneo MN y del receptor CD 44 en la adhesión eritrocitaria. Tesis Doctoral. Rosario: Facultad de Cs. Bioq. y Farm. Univ. Nacional de Rosario, Argentina; 2000. [ Links ]
21. Wackerly D, Mendenhall W, Scheaffer R. Estadística matemática con aplicaciones. México D.C.: Thomson Learning, 2003. [ Links ]
22. Faimbon L. Introducción a la Inmunología Humana. 5ª Ed. Buenos Aires: Médica Panamericana; 2005. [ Links ]
Aceptado para su publicación el 12 de junio de 2009
 Fórmula orgánica estructurada del ácido hialurónico. |
||
| General | ||
| Fórmula semidesarrollada | (-4GlcUAβ1-3GlcNAcβ1)n | |
| Fórmula molecular | C14H21NO11 | |
| Familia | Polisacárido | |
| Compuestos relacionados | ||
| [editar datos en Wikidata] | ||
INMUNOLOGÍA
Estudio de la captación de ácido hialurónico por Ascaris lumbricoidesStudy of hyaluronic acid capture by Ascaris lumbricoides
Patricia Ponce de León1 *, Patricia Foresto2 **, Juana Valverde2 **
1. Bioquímica
2. Doctora en Ciencias Bioquímicas
* Laboratorio de Parasitología. Facultad de Cs. Bioquímicas y Farmacéuticas. UNR. Santa Fe. Argentina.
** Laboratorio de Inmunohematología, Hemorrelogía e Inmunogenética. Facultad de Cs. Bioquímicas y Farmacéuticas. UNR. Santa Fe. Argentina.
Resumen
El ácido hialurónico (AH) tiene importantes funciones en la inmunidad. En experiencias previas se demostró que extractos de adultos de A. lumbricoides y concentrados larvarios, tienen capacidad de unión a AH. El objetivo de este trabajo fue estudiar la captación de AH por este helminto. Se trabajó con tres extractos del parásito adulto ([EA]B,C,D) y 3 concentrados de larvas ([CLAL1]: 1100 a 1200 larvas/ mL; [CLAL2]: 400 a 600 larvas/ mL y [CLAL3]: 100 a 200 larvas/ mL). Se empleó la técnica modificada de Inhibición de la Adhesión para detección del Receptor CD44 soluble de hialuronato en suero humano. Se definió CexpAdhEAH como el cociente entre los eritrocitos adheridos por el AH en presencia y ausencia del parásito y se definió IexpCPAH, como la cantidad de eritrocitos que se dejaron de adherir debido a la captación de AH por el parásito, referido al número total de eritrocitos. Los resultados mostraron diferencias significativas en CexpAdhEAH y en IexpCPAH, por efecto de la concentración larvaria y del [EA]. Las medias aritméticas de CexpAdhEAH y de IexpCPAH para los concentrados larvarios fueron 0,636 y 0,21 ([CLAL1]); 0,819 y 0,068 ([CLAL2]); 0,97 y 0,013 ([CLAL3]). Las medianas de CexpAdhEAH y de IexpCPAH para los extractos fueron [EA]C 0,275 y 0,4; [EA]B: 0,20 y 0,43; [EA]D: 0,075 y 0,495. La experiencia permitiría suponer que el parásito puede captar AH para interferir en la respuesta inmune del hospedador.
Palabras clave: Ascaris lumbricoides; Ácido hialurónico; Captación
Summary
Hyaluronan Acid (HA) has important functions in immunity. Previous experiences have shown that A. lumbricoides’s extracts of adult specimens and larval concentrates have hyaluronan binding capacity. The aim of this study was to analyse the HA capture by this helminth. Three extracts of adult specimens ([AE]B,C,D) and 3 larval concentrates ([ALLC1]: 1100 to 1200 larvae/ mL; [ALLC2]: 400 to 600 larvae/ mL and [ALLC3]: 100 to 200 larvae/ mL) were studied. The modified test of serum soluble CD44 Detection by Aggregation Inhibition was used. CexpAdhEAH was defined as the quotient between erythrocytes adhered by the HA in presence and in absence of the parasite, and IexpCPAH was defined as the amount of erythrocytes that stopped adhering due to the HA capture by the parasite in relation to the total number of erythrocytes. The results showed significant differences in CexpAdhEAH and IexpCPAH as the result of larvae concentration and of the extracts. The arithmetic means of CexpAdhEAH and IexpCPAH for the larvae were 0.636 and 0.21 ([ALLC1]); 0.819 and 0.068 ([ALLC2]); 0.97 and 0.013 ([ALLC3]). Medians of CexpAdhEAH and IexpCPAH for the extracts were [EA]C:0.275 and 0.4; [EA]B: 0.20 and 0.43; [EA]D: 0.075 and 0.495. From the experience, it could be assumed that the parasite can capture the HA to interfere in the host’s immune response.
Keywords: Ascaris lumbricoides; Hyaluronic acid; Capture
Introducción
El ácido hialurónico (AH) es un glicosaminoglicano constituido por residuos alternantes de ácido glucurónico y N-acetilglucosamina. No tiene una forma definida en el espacio, sino que se extiende aleatoriamente tendiendo a ocupar un volumen muy grande debido a la repulsión electrostática de los grupos carboxilo del ácido urónico (1).
El AH no sólo representa el componente fundamental de la matriz extracelular de diversos órganos, tejidos, y articulaciones (2), sino que también participa activamente en su estabilización. El Inter –Alfa –Inhibidor (IAI) es un complejo proteico sanguíneo con actividad antiinflamatoria formado por una cadena liviana de bikunina (ITIL) y dos cadenas pesadas de interinhibidor (ITIHs). Tiene actividad anti-proteasa y por eso ejerce efectos anti-inflamatorios bloqueando la actividad biológica de enzimas plasmáticas, así como las liberadas por inmunocitos tipo neutrofilos. ITIHs pueden ser transferidas desde el IAI a moléculas de AH para unirse covalentemente y formar complejos AH-ITIHs en la matriz extracelular que aseguran su estabilidad (3)
El AH tiene también un rol importante en la respuesta inmune. Es el constituyente principal del tejido conjuntivo, que es una de las barreras mecánicas naturales (4). Su viscosidad ayuda a prevenir el pasaje de virus y bacterias por la zona pericelular (5)(6). Es un reconocido estimulador del proceso inflamatorio que tiene propiedades antioxidantes, capacidad para eliminar radicales libres y actúa como barrera de degradación tisular (7-9). Asimismo, puede activar células dendríticas por TLR4 (Receptor Símil Toll 4) (10) y es ligando de moléculas de adhesión fundamentales en la respuesta inmune (11).
Se ha comunicado que a pesar de que los mecanismos celulares de muchos procesos infecciosos no se conocen con exactitud, podrían involucrar a los glicoconjugados del parásito y del hospedador (12).
Debido al amplio espectro de funciones biológicas del AH y a las múltiples estrategias de evasión parasitaria de la respuesta inmune, en experiencias previas se investigó si extractos preparados a partir de la cutícula de ejemplares adultos de A. lumbricoides podían unir AH. Los resultados demostraron que el 63,89% de los 36 extractos estudiados tenían capacidad de unión a AH, indicando la existencia de un receptor en el nematodo con capacidad de unión a este heteropolisacárido (13).
Como la quitina es otro polisacárido, indispensable para el desarrollo de las cubiertas de los helmintos, y se ha demostrado similitud entre los mecanismos biosintéticos de AH y de quitina (14), se consideró la posibilidad de que los receptores para quitina fueran los que captaban AH. Por ese motivo, se realizaron experiencias con larvas de A. lumbricoides, ya que carecen de quitina, donde se demostró que los estadios larvales también tienen capacidad de unión de AH (15).
Las investigaciones realizadas demuestran que A. lumbricoides capta AH, lo que sugeriría una competencia entre los receptores del parásito y el hospedador por la unión a este ligando. El objetivo de esta experiencia fue estudiar la captación de AH por este nematodo.
Materiales y Métodos
MUESTRAS
Extractos de A. lumbricoides ([EA]): Se trabajó con tres extractos parasitarios ([EA] B, [EA] C y [EA] D) obtenidos a partir de la remoción de la cutícula de ejemplares adultos y ruptura mecánica refrigerada (16). Los [EA] fueron seleccionados porque habían unido AH en las experiencias previas (13).
Concentrados de larvas ([CLAL]): Se utilizaron 3 concentrados de larvas (L1/ L2) obtenidos de la embrionación in vitro (17) y posterior eclosión de huevos de A. lumbricoides (18). Las larvas fueron recolectadas a 37 ºC por el método de Baermann-Moraes (19) en buffer fosfato. Completada la recolección fueron concentradas por centrifugación y se procedió al recuento de las mismas: [CLAL1] tenía 1100 a 1200 larvas/mL; [CLAL2] 400 a 600 larvas / mL y [CLAL3] 100 a 200 larvas / mL.
MÉTODO
El método empleado fue una modificación de la técnica de Inhibición de la Agregación por Adhesión para detección del Receptor CD44 soluble de hialuronato en suero humano (20).
Para ello se utilizó una suspensión al 2% de eritrocitos Grupo O en medio enzimático de bromelina (15 min a 37 ºC), que es el mismo sistema revelador descrito por la técnica original (20). Se separó el plasma autólogo (PA) correspondiente a dichos hematíes.
Se preparó una suspensión de AH 1/128 (20) y una suspensión en partes iguales de AH 1/64 y [CLAL] o [EA], según correspondió (13)(15), que se dejó en contacto 30 minutos a 4 ºC, a los fines de hacer posible la unión del ácido hialurónico con el extracto parasitario o las larvas.
A continuación se prepararon 3 tubos y se dejaron 1 hora a 4 ºC.
Tubo 1: 50 µL de PA + 50 µL de PBS (buffer fosfato pH 7,4) + 50 µL GR 2%Pasado este tiempo se procedió al conteo microscópico de eritrocitos libres, en una cámara de Neubahuer.
Tubo 2: 50 µL de PA + 50 µL de AH 1/128 + 50 µL GR 2%
Tubo 3: 50 µL de PA + 50 µL de AH- [CLAL] / [EA] + 50 µL GR 2%
El conteo del Tubo 1 correspondió al Total de células libres (T). Los Tubos 2 (AH 1/128) y 3 (AH-[CLAL]/ [EA]), permitieron la visualización microscópica de los eritrocitos adheridos por agregación por efecto del AH, y en ellos se contaron solamente los hematíes libres. Los conteos de ambos tubos indicaron el número de glóbulos que no fueron adheridos en las condiciones experimentales. Todos los conteos se hicieron por duplicado y se consideró el valor promedio.
En el Tubo 2 (donde se colocó AH) el valor esperado de eritrocitos libres debía ser menor que en el Tubo 3 (donde se agregó la mezcla AH- [CLAL] / [EA]), pues la captación de AH por el parásito dejaría una menor cantidad de AH libre, lo que se traduciría en una menor adhesión eritrocitaria y un mayor número de células rojas libres.
La diferencia de conteo de células libres del Tubo 1 con respecto a los Tubos 2 y 3, indicó la cantidad de eritrocitos que se adhirieron por agregación en ambos casos.
T – AH = glóbulos rojos adheridos por la acción del AH (GrAdhAH)Se definió el Coeficiente Experimental de Adhesión Eritrocitaria por Ácido Hialurónico, como el cociente entre los glóbulos rojos adheridos cuando el AH se pone en contacto con el parásito y los glóbulos rojos adheridos cuando el AH está en ausencia del parásito, en las mismas condiciones experimentales. Este coeficiente indica el porcentaje de células que se adhieren después de la captación de AH por el parásito en relación a las adheridas por el AH total adicionado.
T- [AH-CLAL] / [EA] = glóbulos rojos adheridos por el remanente de AH que no fue captado por el parásito (GrAdhRAH)
Cuando el parásito no capta AH, el coeficiente es igual o cercano a 1, porque habrá una cantidad igual o similar de células adheridas en los Tubos 2 y 3. Por el contrario, el coeficiente será menor, a mayor cantidad de AH captado por A. lumbricoides.
Se define el Índice Experimental de Captación parasitaria de AH como la cantidad de eritrocitos que se dejaron de adherir porque el parásito captó AH, referido al número total de eritrocitos, en las condiciones experimentales definidas. Este índice es una medida del consumo de AH por el parásito, en las condiciones experimentales establecidas, y se expresa como la cantidad de eritrocitos que se dejaron de adherir por acción del parásito en relación a la cantidad total de glóbulos rojos.
Cuando mayor cantidad de AH capta el parásito, menor será el AH remanente, y menor la cantidad de glóbulos rojos adheridos (Tubo 3), por lo que este índice aumenta.
ANÁLISIS ESTADÍSTICOS
Para el análisis de ambas variables (CexpAdhEAH e IexpCPAH) empleando los concentrados larvarios, se utilizó un análisis de la variancia a un criterio de clasificación y las comparaciones múltiples de Tukey, debido a que se verificó el cumplimiento de los supuestos exigidos por la técnica estadística (21).
Para el estudio del efecto de los distintos [EA] en ambas variables (CexpAdhEAH e IexpCPAH) se utilizó la prueba de Kruskal-Wallis y las comparaciones múltiples de Dunn (21).
Resultados
[CLAL1] (1000 a 1200 larvas / mL)
Se hicieron las experiencias de captación de AH por las larvas utilizando 10 suspensiones globulares.
Los valores de CexpAdhEAH indicaron que después de que las larvas captaron AH (Tubo 3), el remanente de este heteropolisacárido sólo pudo adherir el 64% de los eritrocitos que se habían adherido en ausencia del parásito en las mismas condiciones experimentales (Tubo 2). La media aritmética de CexpAdhEAH fue 0,636 con una desviación estándar de 0,0675278.
En las condiciones experimentales definidas, los valores obtenidos de IexpCPAH indicaron que las larvas captaron el AH necesario para adherir alrededor del 21% de los eritrocitos totales, siendo la media aritmética 0,211 y la desviación estandar 0,0268535. Los resultados se muestran en la Tabla I.
Tabla I. Estudio de la captación de ácido hialurónico por los Concentrados Larvales de A. lumbricoides.
[CLAL2] (400 a 600 larvas / mL)El estudio de la captación de AH por las larvas se realizó con 13 suspensiones globulares.
Los valores de CexpAdhEAH fueron, tal como se esperaba, más altos que en el caso anterior pues la concentración de larvas era menor y por lo tanto también más baja la cantidad de AH captado por ellas. El rango de los valores de CexpAdhEAH estuvo comprendido entre 0,70 y 0,91 con una media aritmética de 0,819231 y una desviación estándar de 0,06788.
En las condiciones experimentales definidas en el Tubo 3 se adhirieron por agregación aproximadamente el 82% de los eritrocitos adheridos en ausencia del parásito (Tubo 2).
La concentración de larvas de [CLAL2] captó el AH necesario para adherir un valor = al 10% de los eritrocitos totales (la media de los valores de IexpC PAH fue 0,0684615 y la desviación estándar 0,0199358)
Los resultados se muestran en la Tabla I.
[CLAL3] (100 a 200 larvas / mL)
Se calcularon los valores de CexpAdhE AH correspondientes a 4 suspensiones globulares para [CLAL3]. Se observó que los coeficientes fueron = 0,96, indicando que el consumo de AH por las larvas, era muy pequeño, tal como se esperaba debido a la concentración larvaria utilizada. Los eritrocitos adheridos en el Tubo 3 (mezcla AH- [CLAL3]) fueron el 96-98% de los que se habían adherido en el Tubo 2 (AH). La media aritmética de los valores de CexpAdhE AH fue 0,9725 con una desviación estándar de 0,00957427.
Los valores del IexpCPAH indicaron que esta concentración de larvas sólo captaba el AH necesario para adherir aproximadamente el 1% de los eritrocitos totales (la media aritmética fue 0,01325 y la desviación estándar 0,00485627).
Los resultados se muestran en la Tabla I.
ANÁLISIS ESTADÍSTICO
Se concluye que existen diferencias significativas en CexpAdhEAH por efecto de la concentración de larvas (p<0,0001).
Los valores promedios de CexpAdhEAH para [CLAL1] son significativamente menores que los correspondientes a los otros dos concentrados larvales. El promedio para [CLAL2] es además significativamente menor que para [CLAL3] (p<0,01).
Se concluye que existen diferencias significativas en el promedio de IexpCPAH por efecto de la concentración de larvas (p<0,0001).
Los valores promedios del IexpCPAH para la mayor concentración larvaria son significativamente mayores que los correspondientes a las otras dos concentraciones de larvas, así como también el promedio para la concentración de 400 a 600 larvas /mL es significativamente mayor que para la concentración de 100 a 200 larvas /mL (p<0,01).
[EA]a,b,cPara estudiar la captación de AH por extractos del parásito adulto, se utilizaron 10 suspensiones eritrocitarias, cada una de las cuales fue ensayada con los 3 [EA].
En experiencias preliminares, se aplicó la técnica de Inhibición de la Agregación por Adhesión para detección del Receptor CD44 soluble de hialuronato en suero humano y se demostró que los tres tenían capacidad de unión de AH.
Los valores de CexpAdhEAH obtenidos mostraron que el [EA] C dejó un remanente de AH después de la captación, que adhería aproximadamente el 28% de los eritrocitos que se habían adherido en ausencia del extracto (el valor de la mediana fue 0,275 y el rango intercuartil 0,05). El AH remanente después del contacto con el [EA] B y con el [EA] D adhirió el 20% de los eritrocitos adheridos en el Tubo 2 (mediana 0,2 y rango intercuartil 0,04) y el 7-8% (mediana 0,075 y rango intercuartil 0,06) respectivamente.
Estos coeficientes indicaron que el [EA] D era el que tenía mayor capacidad de unión a AH.
Los valores de la mediana y el rango intercuartil de IexpCPAH fueron 0,4 y 0,07 para [EA] C; 0,43 y 0,04 para [EA] B; 0,495 y 0,06 para [EA] D.
Los resultados se muestran en la Tabla II.
Tabla II. Estudio de la captación de ácido hialurónico por extractos de A. lumbricoides.

ANÁLISIS ESTADÍSTICOSe concluye que existen diferencias significativas en el CexpAdhEAH por efecto del extracto parasitario (p<0,0001).
Los valores de CexpAdhEAH para [EA]C son significativamente mayores que los correspondientes a los otros dos, siendo además para el [EA] B significativamente mayores que para el [EA] D (p<0,05).
Se concluye que existen diferencias significativas en el IexpCPAH por efecto del extracto parasitario (p<0,0001).
Los valores de IexpCPAH para [EA] D son significativamente mayores que para los otros dos extractos cuyos valores no difieren entre sí (p<0,05).
Discusión y Conclusiones
El AH participa en varias etapas de la respuesta inmune. En la resistencia natural, para impedir la penetración de gérmenes, participan las barreras mecánicas formadas por la piel, las mucosas (muchas con un epitelio ciliado o vibrátil y el manto de moco que las recubre) y las secreciones, que actúan a modo de lavado y arrastre. Otras defensas más profundas son las diferentes fascias y aponeurosis, y sobre todo, la especial constitución del tejido conjuntivo a manera de espesa malla de ácido hialurónico (4). El AH es simultáneamente componente y estabilizador de la matriz extracelular, con propiedades hidrofílicas, y desempeña un rol importantísimo de génesis, mantenimiento y resolución de la inflamación en la respuesta innata (3).
Por otro lado, se ha comunicado que el AH puede activar células dendríticas a través del TLR4 (Receptor Toll 4) (10). Los TLR son los receptores principalmente involucrados en la activación a nivel intestinal. Si bien las experiencias realizadas indicarían que los TLR no participarían en el reconocimiento de helmintos, tampoco se ha determinado claramente cuál sería el receptor involucrado (22).
Los hialuronatos son componentes sacáridos ligandos de importantes hialuroadherinas y moléculas de adhesión. Entre las primeras se encuentra TSG6 (factor estimulador de necrosis tumoral gen 6) que es una proteína soluble. El grupo de moléculas de adhesión que son receptores de AH, tiene dos miembros, ambos codificados por el gen ras: el CD44 (también denominado Pgp-1, H-CAM, GP90 o HER-MES) y el RHAMM (receptor para la motilidad mediada por hialuronato) (11). CD44 es una glicoproteína transmembrana relacionada con la interacción entre células y matriz extracelular, se expresa en leucocitos, células epiteliales, células gliales, fibroblastos y células musculares. Se la considera una molécula de adhesión, con acción quimiotáctica para linfocitos en el tejido linfoide de las mucosas (placas de Peyer), además se la relaciona a activación leucocitaria, linfopoyesis y metástasis tumoral (11). La proteína RHAMM activa un mecanismo locomotor que permite la adhesión entre las células por inducción transitoria de la fosforilación de la proteína tirosina al comportarse como una tirosina quinasa. Se expresa en la mayoría de linfocitos B periféricos y se cree que está relacionada a su activación (11). La adhesión de AH a RHAMM induce la quimiotaxis y a CD44 se cree que actuaría como una ruta de recaptación para la degradación lisosomal (3).
Experiencias previas han demostrado que los extractos de la cutícula del parásito adulto y los estadios larvales de A. lumbricoides tienen receptores que unen AH (13)(15). En el parásito adulto, esta unión podría deberse a la presencia de uno o más tipos de receptores, pero se desconoce hasta el momento si este receptor es específico para AH, o es un receptor para quitina, o si existen ambos que en forma simultánea pueden realizar la captación (13).
Los resultados obtenidos al estudiar la captación de AH por los concentrados larvales demostraron claramente que a mayor cantidad de larvas, mayor es la cantidad de AH secuestrado por ellas. En las condiciones experimentales definidas, la mezcla AH-[CLAL1] (1000-1200 larvas/mL) dejó un remanente de AH que adhirió el 64% de los eritrocitos que se habían adherido en ausencia de larvas y la mezcla AH-[CLAL2] (400-600 larvas/mL) dejó libre una cantidad de AH como para adherir el 82% de los hematíes que se habían agregado en el Tubo 2. La mezcla AH-[CLAL3] (100-200 larvas/mL) captó tan poca cantidad de AH, que se adhirieron la casi totalidad de los eritrocitos adheridos cuando las larvas no estaban presentes.
Los análisis estadísticos concluyeron que existen diferencias significativas en el valor de CexpAdhEAH por efecto de la concentración de larvas.
El valor del IexpCPAH también demostró que el consumo de AH por las larvas se relaciona en forma directa con la concentración larvaria, pues los resultados del análisis estadístico permitieron concluir que existen diferencias significativas en el promedio de IexpCPAH por efecto de la concentración de larvas.
Se observó que si bien concentraciones tan bajas como las de [CLAL3] captan el AH necesario para adherir el 1% de los eritrocitos totales de la experiencia, [CLAL2] y [CLAL1] pueden captar el AH que adhiere el 7% y 21%, respectivamente, de las células rojas totales. Estos resultados demostraron que el secuestro de AH por el parásito durante la infección, podría tener un valor significativo dependiendo de la concentración de larvas circulantes.
La técnica de Inhibición de la Agregación por Adhesión para detección del Receptor CD44 soluble de hialuronato en suero humano, utiliza dos series de diluciones de un suero (con alto título de CD44 soluble) donde se agrega AH en la primera serie y AH- [EA]/[CLAL] en la segunda. Se revela con eritrocitos Grupo O y se determina el título de CD44 soluble en ambas series. Se considera significativa una diferencia de dos o más diluciones entre los títulos de las dos series (14)(15). Cuando se aplicó esta metodología con los [EA]B,C,D, se observó que la diferencia de título era de 2 diluciones con el [EA]C, 3 con el [EA]B, y 5 diluciones con el [EA]D, lo que indicó que este último extracto era el que más AH captaba. En estas experiencias, los valores hallados de CexpAdh EAH se correlacionaron con los observados previamente, ya que [EA]D dejó un remanente de AH como para adherir solamente el 8% de los eritrocitos adheridos en el Tubo 2, el [EA]B el 20% y el [EA]C un remanente de AH como para adherir el 28% de los hematíes adheridos en ausencia de extracto. El análisis estadístico concluyó que existen diferencias significativas en el valor de CexpAdhEAH por efecto del extracto parasitario.
Los valores de IexpCPAH demostraron que los [EA] captan el AH necesario para adherir entre un 40-50% de los eritrocitos totales, indicando que la acción del parásito adulto en la captación podría ser más relevante que en los estadíos larvales. El análisis estadístico demostró que el valor de IexpCPAH obtenido con el [EA]D tiene una diferencia significativa con los valores obtenidos de este índice con los otros dos extractos.
Si se considera la importancia de las funciones biológicas del AH, los resultados obtenidos con esta experiencia permitirían especular que el parásito lo capta para interferir en el desarrollo de la respuesta inmune del hospedador. Esta captación puede constituir una estrategia de evasión.
CORRESPONDENCIA
DRA. PATRICIA PONCE DE LEÓN
Laboratorio de Parasitología. Dpto. de Microbiología
Facultad de Cs. Bioquímicas y Farmacéuticas
Suipacha 531
2000 ROSARIO, Santa Fe, Argentina
E-mail: tefu1958@hotmail.com
Referencias bibliográficas
1. Battaner Arias E. Universidad de Salamanca, Dpto de Bioquímica y Biología Molecular. Modelos Moleculares 2: Hidratos de Carbono. Disponible en: http://www.usal.es/~dbbm/modmol/modmol02/mm02t01.htm [Fecha de acceso: 2 de agosto de 2009]. [ Links ]
2. Longaker MT, Chiu ES, Adzick NSm, Stern M, Harrison MR, Stern R. Studies in fetal wound healing. A prolonged presence of hyaluronic acid characterizes fetal wound fluid. Ann Surg 1991; 213: 292-6. [ Links ]
3. García G, Hernández S, Mejía O, Baez S, García A. Biología y patobiología humana del ácido hialurónico en la estabilización de la matriz extracelular y la inflamación. Rev Med 2006; 14 (1): 80-7. [ Links ]
4. Bondia García-Puente M. Gran Enciclopedia Rialp: Humanidades y Ciencia. Madrid: Ediciones Rialp SA; 1991. [ Links ]
5. Chen WYJ, Abatangelo G. Functions of hyaluronan in wound repair. Wound Rep Reg 1999; 7: 79-89. [ Links ]
6. Knudson CB, Knudson W. Hyaluronan-binding proteins in development, tissue homeostasis, and disease. FASEB J 1993; 7: 1233-41. [ Links ]
7. Cortivo R, Brun P, Cardarelli L, O’regan M, Conconi Mt, Radice M, et al. Antioxidant effects of hyaluronan and its alpha-methyl-prednisolone derivative in chrondrocyte and cartilage cultures. Sem Arthritis Rheum 1996; 26: 492-501. [ Links ]
8. Nitzan DW, Nitzan U, Dan P, Yedgar S. The role of hyaluronic acid in protecting surface-active phospholipids from lysis by exogenous phospholipase A(2) Rheumatology 2001; 40: 336-40. [ Links ]
9. Presti D, Scott JE. Hyaluronan-mediated protective effect against cell damage caused by enzymatically produced hydroxyl (OH) radical is dependent on hyaluronan molecular mass. Cell Biochem Funct 1994; 12: 281-8. [ Links ]
10. Takeda K, Kaisho T, Akira S. Toll-Like Receptors. Ann Rev Immunol 2003; 21: 335-76. [ Links ]
11. Sanguineti AC, Rodriguez-Tafur JM. Moleculas de Adhesión y Piel. Dermatol Peruana 1999; 9(1). Disponible en: http://www.sisbib.unmsm.edu.pe/Bvrevistas/dermatología/v09_sup1/moléculas.htm [Fecha de acceso: 2 de agosto de 2009]. [ Links ]
12. Souto Padron T. The surface charge of trypanosomatids. An Acad Bras Ciênc 2002; 74 (4): 649-75. [ Links ]
13. Ponce de León P, Foresto P, Valverde J. Ascaris lumbricoides: Capacidad de unión a Hialuronato Acta Bioquím Clín Latinoam 2007; 41(4): 519-24. [ Links ]
14. Takeo S, Fujise M, Akiyama T, Habuchi H, Itano N, Matsuo T, et al. In vivo hyaluronan synthesis upon expression of the mammalian hyaluronan cintasa gene in Drosophila. J Biol Chem 2004; 279: 18920-5. [ Links ]
15. Ponce de León P, Foresto P, Valverde J. Estados larvales de Ascaris lumbricoides: capacidad de unión a ácido hialurónico. Rev Invest Clín 2008; 50: 5-12. [ Links ]
16. Ponce de León P, Valverde J, Zdero M. Preliminary studies on antigenic mimicry of Ascaris lumbricoides. Rev Inst Med Trop S Paulo 2000; 42: 295-6. [ Links ]
17. Fairbairn D. The in vitro hatching of Ascaris lumbricoides eggs. Canad J Zool 1961; 39: 153-62. [ Links ]
18. Geenen PL, Bresciani JB, Pedersen A, Eirksen H, Fagerholm PN. The morphogenesis of Ascaris suum to the infective third-stage larvae within the egg. J Parasitol 1999; 85 (4): 616-22. [ Links ]
19. Shore García L, Ash L. Diagnóstico parasitológico. 2ª Ed. Buenos Aires: Médica Panamericana; 1983. [ Links ]
20. D’Arrigo M. Incidencia de la relación estructura- función del Sistema de Grupo Sanguíneo MN y del receptor CD 44 en la adhesión eritrocitaria. Tesis Doctoral. Rosario: Facultad de Cs. Bioq. y Farm. Univ. Nacional de Rosario, Argentina; 2000. [ Links ]
21. Wackerly D, Mendenhall W, Scheaffer R. Estadística matemática con aplicaciones. México D.C.: Thomson Learning, 2003. [ Links ]
22. Faimbon L. Introducción a la Inmunología Humana. 5ª Ed. Buenos Aires: Médica Panamericana; 2005. [ Links ]
Aceptado para su publicación el 12 de junio de 2009

El origen exacto de la apiterapia es difícil de determinar y puede ser rastreado hasta el antiguo Egipto, Grecia y China. La miel y otros productos de abejas se han utilizado desde hace miles de años y sus propiedades curativas se han incluido en varios textos religiosos como los Vedas, la Biblia y el Corán. Estos se han atribuido sobre todo a los beneficios nutricionales del consumo de los productos de las abejas y no al uso del veneno. Existen referencias sobre la apiterapia desde el papiro de Ebers 1700 a. C. en la Torá Pentateuco, en la Biblia, y en los escritos de Aristóteles, Plinio, Discórides, Galeno, Hipócrates, Varrón, Avicena, etc.
Existen relatos como la cura de gota de Carlomagno (748-814) o el dolor articular de Iván el Terrible (1530-1548) con picaduras de abeja.
Un estudio más actual sobre la apiterapia, específicamente del veneno, se inició mediante los esfuerzos del físico australiano Philip Terc, publicados en 1888: “Informe sobre una conexión peculiar entre los piquetes de abeja y el reumatismo” (Report about a Peculiar Connection Between the Bee stings and Rheumatism). Su más reciente popularidad se debe a Charles Mraz, apicultor de Vermont, Estados Unidos (véase también Bodog Beck, M.D.).
En el siglo XX cabe destacar a Filip Terc, reconocido como el padre de la apiterapia, y el doctor Bodog F. Beck quien ya usó la palabra apiterapia para referirse a este tratamiento natural. Posteriormente, Charles Mraz (1905-1999) quien promovió la fundación de la American Apitherapy Society.
Aplicación
Aunque la apiterapia incluye el uso y el consumo de productos de abejas, el término se asocia sólo con la terapia del veneno y no con el consumo de la miel o de otros productos de las abejas. La terapia del veneno de las abejas se utiliza como tratamiento para disolver los tejidos con cicatrices (queloides).4El componente activo más abundante del veneno es la melitina (50 por ciento del peso seco del veneno de abejas), la cual tiene acción antiinflamatoria. Sin embargo, el veneno de abeja es una mezcla compleja de varios péptidos y proteínas, algunos de los cuales tienen efectos neurotóxicos e inmunológicos.[cita requerida]
No existe una práctica estandarizada para la administración del veneno de abeja. Algunos sustentan que la localización de la picada es importante, ya que para ellos el aguijón actúa como un tipo de acupuntura en combinación con los efectos del veneno; otros señalan que la localización no es importante. El número de picadas también varía ampliamente, desde unas cuantas hasta cientos y pueden ser administradas por abejas vivas o por inyecciones. Recientemente se ha logrado la extracción del veneno de abejas en el laboratorio, lo que vuelve más segura la aplicación mediante el control de la dosificación, del sitio de aplicación y con un menor riesgo de infecciones.[cita requerida]
Efectos secundarios
Este tratamiento puede causar dolor e inclusive puede terminar en la muerte si la persona es alérgica al veneno de abejas, lo cual puede producir un choque anafiláctico: es por este motivo que en los centros de apiterapia se realizan pruebas de sensibilidad para minimizar este riesgo.Investigación
En un estudio supervisado por la Universidad de las Ciencias de la Salud de Allegheny (Allegheny University of the Health Sciences), en Filadelfia, se descubrió que el veneno de abejas no tiene efectos positivos con ninguna dosificación en ratones con encefalomielitis autoinmune experimental, el equivalente animal de la esclerosis múltiple. Además, muchos de los animales presentaron peores síntomas que los del grupo placebo. Recientemente se caracterizó un modelo de esclerosis múltiple en ratas que mostraba resultados prometedores.[cita requerida]La fase I de un estudio realizado en el centro médico de la Universidad de Georgetown, en Washington, DC, financiado por la Asociación de Esclerosis Múltiple de América (MSAA, por sus siglas en inglés), se diseñó para determinar la seguridad en la administración de tratamientos del veneno de abeja en los seres humanos con esclerosis múltiple.
Otros estudios preclínicos y clínicos han comenzado a construir la evidencia científica en torno al uso de los productos de la colmena como tratamiento para enfermedades.[cita requerida]
- manejo del dolor musculoesquelético (nivel de evidencia A)
- manejo de la artritis (nivel de evidencia B)
- manejo de la artrosis-osteoartritis (nivel de evidencia B)
Bibliografía
- Este artículo se creó a partir de la traducción de en:apitherapy
- Asís M. Apiterapia 101 para todos. American Apitherapy Society. 2007. ISBN 978-1-890829-43-8. y [1]
PROYECTO
1
CARACTERIZAR
LA INFLUENCIA DEL ETILENO EN LA MADURACIÓN DE LOS FRUTOS.
Manejo de etileno durante
el almacenaje poscosecha (acreditado)
 El etileno se comporta de la
misma manera que las hormonas en los mamíferos y desencadena eventos
específicos durante el curso natural de crecimiento y desarrollo.
El etileno se comporta de la
misma manera que las hormonas en los mamíferos y desencadena eventos
específicos durante el curso natural de crecimiento y desarrollo.
Las
frutas, hortalizas y flores frescas están al máximo de su calidad cuando son
cosechadas y esa calidad puede mantenerse o deteriorarse durante su manejo y
almacenamiento.
Mantener
la calidad del cultivo después de la cosecha es de suma importancia para cualquier productor o
distribuidor de frutas, hortalizas y flores dirigidas al mercado de productos
frescos. Este artículo se refiere a dos factores importantes relacionados con
la calidad poscosecha de las frutas, las hortalizas y las flores de corte: la
respiración y el etileno.
Respiración
después de la cosecha
Aún después de haber sido cosechados de las plantas, las frutas, hortalizas y flores de corte continúan siendo órganos vivos. Tal y como ocurre con todos los tejidos vivos, las frutas, hortalizas y flores de corte cosechadas continúan respirando a lo largo de su vida poscosecha.
Aún después de haber sido cosechados de las plantas, las frutas, hortalizas y flores de corte continúan siendo órganos vivos. Tal y como ocurre con todos los tejidos vivos, las frutas, hortalizas y flores de corte cosechadas continúan respirando a lo largo de su vida poscosecha.
Durante
el proceso de respiración de descomponen los carbohidratos en sus componentes
para producir la energía requerida para realizar los procesos celulares,
manteniendo vivas a las células y a los organismos. A través de este proceso,
se consume oxígeno y agua y se libera dióxido de carbono y energía.
Debido a que este proceso ocurre desde la cosecha hasta la mesa, los carbohidratos almacenados en la sección cosechada de la planta son “quemados” de manera continua como fuente de energía que mantiene vivo al vegetal. Mientras continúa el proceso de respiración se van perdiendo los compuestos que afectan el sabor, la dulzura, el peso, la turgencia (contenido de agua) y el valor nutricional.
Debido a que este proceso ocurre desde la cosecha hasta la mesa, los carbohidratos almacenados en la sección cosechada de la planta son “quemados” de manera continua como fuente de energía que mantiene vivo al vegetal. Mientras continúa el proceso de respiración se van perdiendo los compuestos que afectan el sabor, la dulzura, el peso, la turgencia (contenido de agua) y el valor nutricional.
Por lo
tanto, es importante reducir la tasa de respiración para prolongar la vida
poscosecha de las frutas, hortalizas y flores de corte, aumentando al máximo su
calidad.
Es
importante notar que las frutas, hortalizas y flores cosechadas de diferentes
plantas tienen distintas tasas de respiración. Asimismo, las condiciones de
almacenaje afectan la respiración.
Las
temperaturas más elevadas aceleran la tasa de respiración — por cada incremento
de 10°C en la temperatura, se duplica o incluso se triplica la tasa de
respiración.
Debido al
importante efecto que tiene la temperatura en la respiración, es esencial
reducir al mínimo el calor al que se exponen las frutas, las hortalizas y las
flores de corte, además de restaurar lo más pronto posible el rango de
temperatura óptimo para el lmacenaje.  Etileno: regulador de crecimiento
Etileno: regulador de crecimiento
El etileno es un gas incoloro producido de manera natural por las plantas que funciona como regulador de crecimiento. En realidad, el etileno se comporta de la misma manera que las hormonas en los mamíferos y desencadena eventos específicos durante el curso natural de crecimiento y desarrollo de las plantas, por ejemplo, el proceso de maduración.
 Etileno: regulador de crecimiento
Etileno: regulador de crecimientoEl etileno es un gas incoloro producido de manera natural por las plantas que funciona como regulador de crecimiento. En realidad, el etileno se comporta de la misma manera que las hormonas en los mamíferos y desencadena eventos específicos durante el curso natural de crecimiento y desarrollo de las plantas, por ejemplo, el proceso de maduración.
Por medio
de ese efecto, el etileno induce cambios en ciertos órganos vegetales como la
textura, cambios de color y degradación del tejido. Algunos de estos cambios
pueden ser cualidades deseables asociadas con la maduración; mientras que en
otros casos pueden producir daños o deterioro prematuro.
Es
posible clasificar las frutas y hortalizas conforme a su respuesta al etileno.
Las especies climatéricas producen etileno al ir madurando y por ello las
frutas y hortalizas cosechadas son capaces de madurar durante el periodo
posterior a la cosecha.
Calidad
durante el transporte
Ciertos productos considerados climatéricos, tales como bananas, manzanas y duraznos tienden a volverse más dulces y blandos después de la cosecha. Por el contrario, las plantas que no son climatéricas como las hortalizas de hoja, no continúan madurando después de la cosecha; estos productos se reblandecen y pudren debido a pérdida de humedad, proceso de descomposición y deterioro del tejido.
Ciertos productos considerados climatéricos, tales como bananas, manzanas y duraznos tienden a volverse más dulces y blandos después de la cosecha. Por el contrario, las plantas que no son climatéricas como las hortalizas de hoja, no continúan madurando después de la cosecha; estos productos se reblandecen y pudren debido a pérdida de humedad, proceso de descomposición y deterioro del tejido.
Además de
ser producido de manera natural por las plantas, el etileno también es
producido por muchas otras fuentes, incluyendo los motores de combustión
interna, el humo de los cigarrillos y las fugas de gas natural.
Incluso
las pequeñas concentraciones de etileno a lo largo de la vida poscosecha de un
producto de consumo básico pueden afectar su calidad, por lo que se debe
intentar reducir al mínimo la exposición al etileno tanto de fuentes naturales
(frutas y hortalizas climatéricas almacenadas con productos que no son
climatéricos), o fuentes artificiales (escapes de motores, calentadores, etc.)
Es
necesario tomar en cuenta todas las fuentes posibles de producción de etileno
para optimizar las condiciones de almacenaje poscosecha y evitar que las
frutas, hortalizas y flores de corte pierdan calidad por estar expuestas a
alguna fuente inadvertida de etileno.
Haz clic
en la próxima página para aprender cómo reducir la exposición al etileno
durante el almacenaje
Fuente:
Artículo “Respiración y Etileno: Su relación con el manejo poscosecha para el
éxito al mayoreo” escrito por Erin Silva, Universidad Estatal de Wisconsin.
Para más información escriba a pdh.edit@meistermedia.com
PROYECTO 2
El uso de la urea como fertilizante
Fertilizantes de urea,
los más utilizados por los agricultores
En las
zonas de cultivos, la utilización de fertilizantes se hizo un proceso muy
común mundialmente. La utilización de estos químicos para poder lograr que
los suelos vuelvan a tener los nutrientes que las plantas necesitan para su
crecimiento es un método que naturalmente se emplea en las hectáreas
dedicadas a las cosechas, donde la sobreexplotación del suelo hace que este
pierda los nutrientes que efectúan el desarrollo de los cultivos. Es así, que
el emplear distintos tipos de fertilizantes es un método ideal para ayudar a
los suelos a conservar su capacidad de fuente de nutrientes.
 Existen distintos tipos de
fertilizantes aplicados a los diferentes tipos de suelos, algunos de ellos
son los fertilizantes de urea y fosfatos. La urea es un compuesto químico, de
apariencia cristalina e incoloro. Gracias a su alto contenido en carbono y
nitrógeno, su utilización para la creación de fertilizantes para las
cosechas, es muy usual. Este compuesto se puede encontrar en la
naturaleza, pero corre con la ventaja de poder ser creado por el hombre. La
urea es un compuesto económico y fácil de trasladar para su utilización en
las cosechas. La aplicación de fertilizantes de urea, es muy comúnmente
utilizada por los productores o agricultores, pero su aplicación se debe
efectuar con cuidado y responsabilidad. Su utilización trae dos problemas a
los cuales quienes se encarguen de su aplicación, deben prestar atención. Existen distintos tipos de
fertilizantes aplicados a los diferentes tipos de suelos, algunos de ellos
son los fertilizantes de urea y fosfatos. La urea es un compuesto químico, de
apariencia cristalina e incoloro. Gracias a su alto contenido en carbono y
nitrógeno, su utilización para la creación de fertilizantes para las
cosechas, es muy usual. Este compuesto se puede encontrar en la
naturaleza, pero corre con la ventaja de poder ser creado por el hombre. La
urea es un compuesto económico y fácil de trasladar para su utilización en
las cosechas. La aplicación de fertilizantes de urea, es muy comúnmente
utilizada por los productores o agricultores, pero su aplicación se debe
efectuar con cuidado y responsabilidad. Su utilización trae dos problemas a
los cuales quienes se encarguen de su aplicación, deben prestar atención.
El
primer inconveniente al cual se enfrentan quienes utilizan este producto, es
que es un compuesto que cuando se aplica en la superficie del suelo, su
volatilización es muy común y se dan grandes pérdidas del mismo, si no se
aplica con precaución. Para evitar esto se puede llegar a recubrir el suelo
antes de la aplicación del fertilizante de urea, y así evitar la perdida del
compuesto como ya hemos explicado.
El
segundo inconveniente, y el más importante, es que su utilización en exceso
o aplicada y el suelo se encuentra a mucha temperatura, puede llevar a una
derivación del compuesto, y esta nueva combinación del mismo con otras
sustancias del suelo, puede llegar a contaminar las plantaciones y destruir
una cosecha de meses. Así es que su aplicación se debe realizar con
las medidas de seguridad necesarias y gente que tenga conocimiento sobre el
trabajo que esta realizando.

La importancia del uso de fertilizantes de urea y
fosfatos
Así es
como los fertilizantes de urea y fosfato son utilizados mundialmente por
cientos de países para lograr grandes producciones, o simplemente aumentar el
nivel de las cosechas. Los fertilizantes de urea y fosfatos son químicos muy
utilizados y muy útiles para el desarrollo de grandes territorios
seleccionados para las cosechas, pero su utilización debe ser cautelosa y
aplicado en cada caso la dosis justa, para no provocar el efecto contrario al
que se quiere llegar. La utilización de fertilizantes de urea y fosfato son
grandes métodos para ayudar a los suelos, y las plantas obtengan los
nutrientes necesarios para su desarrollo y crecimiento, permitiendo también
que la producción total de la cosecha sea mucho mayor, reduciendo
notablemente la cantidad de las plantaciones perdidas por diferentes motivos.
Más allá de que le aportan nutrientes necesarios para su crecimiento, los
fertilizantes ayudan a las plantas para que puedan vencer más fácilmente a
las plagas y enfermedades con las que tienen que lidiar constantemente
durante la etapa de crecimiento, y principalmente durante la primera etapa de
desarrollo.
Así es,
que la utilización de fertilizantes de urea y fosfato permite que las
plantaciones se vuelvan más fuertes y pueden sobrellevar, con la ayuda de los
productos agroquímicos necesarios, distintos tipos de insectos, bacterias y
virus que pueden llegar a afectarlas durante el tiempo que dure la maduración
de sus frutos.
|
¿Qué ventaja ofrece el uso de la urea como fertilizante?
¿Cuáles son sus características?
Tema: El uso de la urea como fertilizante
Fecha: 22-Jul-2008 Fuente: QuimiNet Sectores relacionados:
Agro, Química
campo-de-cultivo.jpg
Foto por: © Getty Images
Campo de cultivo
Agregar a Mi archivero de negocios
Enviar por email
Imprimir
La fertilidad de los suelos es un factor clave para el
crecimiento de las plantas y tiene una gran influencia sobre la productividad y
la calidad del alimento.
El nitrógeno forma parte de cada célula viva por lo que es
esencial en la planta. Generalmente, las plantas requieren de grandes
cantidades de nitrógeno para crecer normalmente. El nitrógeno es necesario para
la síntesis de la clorofila y al formar parte de la molécula de la clorofila,
está involucrado en el proceso de la fotosíntesis.
El nitrógeno forma parte de las vitaminas y de los sistemas
de energía de la planta. Es también un componente esencial de los aminoácidos,
los cuales forman las proteínas; por lo tanto, es directamente responsable del
incremento de proteínas en las plantas, y está directamente relacionado con la
cantidad de hojas, tallos, etc.
La urea como fertilizante presenta la ventaja de
proporcionar un alto contenido de nitrógeno, el cual, como se menciona
anteriormente, es esencial en el metabolismo de la planta.
La mayor parte de la urea producida es usada como
fertilizante, aunque también tiene uso en la industria del plástico y química,
en la fabricación de adhesivos, resinas, tintas, etc.
Proveedores de urea
Para buscar proveedores o empresas que venden urea,
solicitar una cotización o precio de urea o más información, visite nuestro
buscador de la industria.
A continuación le presentamos a Brenntag México S: A. de
C.V., proveedor de urea:
Brenntag México S. A. de C. V., es la compañía líder en la
distribución de productos químicos en el mundo. Contando dentro de su gama de
productos con productos químicos como: urea, acetona, alcohol etílico, anilina,
formaldehído, entre otros más.
Características de la urea de Brenntag
Sinónimos:
Carbamida, resina carbamida, carbonildiamida, isourea,
carbonilamina.
Propiedades físicas:
Apariencia: Polvo
cristalino blanco
Punto de fusión:
135-137°C
Gravedad
específica: 1.335
Manejo y almacenaje:
Para preservar el material con sus propiedades químicas
almacenar a una temperatura de 25 °C y
envases cerrados, proteja los envases de daños para evitar
contaminación. Los envases vacíos puedes ser peligrosos ya que contienen residuos del material.
Usos y aplicaciones principales:
La aplicación principal es en la fabricación de
fertilizantes; otro usos principales son antiespumante, agente activo en la
fabricación de resinas entre otros.
Presentación:
Sacos de 50 kg, entregado en su planta.
Conozca el Perfil, Productos, Dirección y Teléfono de
Brenntag México S. A. de C. V.
O bien, haga contacto directo con Brenntag México S. A. de
C. V., para solicitar mayor información sobre la urea.
El editor recomienda
La sangre animal
como fertilizante
El uso de semillas
de agua como recubrimiento de raíz desnuda
Sitios de interés Petrobras desarrolla fertilizante de urea
Dakota Gas
construirá nueva planta de urea
Yara para
producción de amonio y urea
PROYECTO 3
LOS EDULCORANTES; Ventajas y beneficios sobre el consumo de la fructosa
¿Qué es la fructosa? ¿De dónde se extrae la
fructuosa? ¿Cuáles son los usos y aplicaciones de la fructuosa?
Tema: Ventajas y beneficios sobre el consumo de la
fructosa
Fecha:
01-Dic-2011 Fuente: QuimiNet Sectores relacionados: Industria Alimenticia
 © Getty Images
© Getty Images
Fructosa
Actualmente
los hábitos alimenticios y el consumo de diferentes productos bajos en sodio,
azúcares o grasa han sido uno de los grandes cambios que ha hecho la sociedad
para cuidar su salud.
Uno de
los productos que han adoptado los consumidores para reemplazar el uso de
azúcares es la fructuosa, de esta manera solamente se transforma la manera de
endulzar los alimentos.
Fructuosa
La
fructuosa es considerada como un monosacárido igual que el de la glucosa, pero
con una estructura diferente, pues se trata de tan sólo 6 átomos de carbono con
un poder energético de 4 kilocalorías por cada gramo.
La
fructuosa se puede encontrar en algunos tipos de miel y en frutas naturales y
puede ser extraída y procesada para fabricar sacarosa o azúcar común.
Actualmente
la fructosa está presente en diferentes cantidades en una amplia variedad de
alimentos y se ha convertido en uno de los endulzantes más utilizados por la
industria alimenticia.
Beneficios de la fructosa
Dulzura
La
fructosa es más dulce que el azúcar, por lo tanto, los consumidores pueden
utilizar menos fructosa, pero obtendrían el mismo grado de dulzura en alimentos
y bebidas.
Punto de congelación
La
fructosa tiene un alto punto de congelación por lo tanto puede ser utilizada en
alimentos que necesitan ser congelados o refrigerados a bajas temperaturas.
Sabor a frutas
Cuando se
realizan productos que son elaborados a base de frutas, como yogurts o
natillas, la fructuosa realza aun más su sabor, por provenir de un componente
de éstas.
Índice glucémico bajo
La
fructosa tiene un índice glucémico bajo, por lo tanto ésta puede ser utilizada
en formulaciones alimenticias bajas en carbohidratos. La carga de la glucemia
es un número que refleja la afectación de un alimento azucarado en la sangre,
lo cual se vuelve determinante para las personas con diabetes.
Estabilidad
Al tener
una larga vida útil, la fructosa es utilizada para mejorar el sabor de
productos diseñados para su conserva o para una larga vida en estante.
Ventajas de la fructosa
La
fructosa cuenta con grandes ventajas como son:
- La
fructosa, al tratarse de un carbohidrato, constituye una importante fuente de
energía para el cuerpo humano.
- La
fructosa no aumenta la glucosa de la sangre.
-
Tradicionalmente la fructosa se ha utilizado como edulcorante para los
diabéticos.
- La
fructosa endulza más que el azúcar blanca o refinanda y aporta sólo 4
kilocalorías por gramo.
- Se sabe
que la fructosa es metabolizada y guardada en parte por el hígado en forma de
glucógeno, como reserva para cuando necesitamos hacer un esfuerzo.
Usos y aplicaciones de la
fructosa
Como la
fructosa se encarga de sustituir al azúcar, esta puede ser utilizada en:
-
Alimentos
- Postres
-
Pasteles
-
Gelatinas
- Repostería
- Frutas
- Bebidas
energetizantes
-
Refrescos
-
Cereales
- Yogurt
- Helados
- Bebidas
Proveedores de fructosa
A
continuación le presentamos a Sucromiles, proveedor de fructosa:
Sucromiles es una
empresa productora encargada de transformar el azúcar en ácido cítrico y
citratos y de transformar las mieles en ácido acético, acetatos y alcoholes.
Dentro de
la amplia gama de productos que ofrece Sucromiles se encuentra la fructuosa.
O bien,
haga contacto directo con Sucromiles para solicitar mayor información sobre
su fructosa.
El editor
recomienda
- El citrato de calcio como suplemento dietario
- Descubra cómo el azúcar hace a los plásticos biodegradables
- Los molinos de caña o prensas de caña de azúcar
- Acondicionadores para el secado del azúcar
-

-


TEMA: El contenido de fructuosa y glucosa en frutas y vegetales
|
La
glucosa y la fructosa son las formas más simples de azúcar que pueden
ser absorbidas en el torrente sanguíneo. Estos azúcares están
naturalmente presentes en los alimentos tales como granos, frutas y
verduras. Ellos también son los principales ingredientes en muchos
edulcorantes y alimentos procesados. Si tienes intolerancia a la
fructosa, es necesario evitar los alimentos con alto contenido de
fructosa. En una reciente revisión publicada en "Nutrition",
investigadores de la Universidad de Lausana en Suiza, dicen que cuando
la fructosa se consume en cantidades excesivas como parte de una dieta
alta en calorías, que puede contribuir al desarrollo del síndrome
metabólico, un factor de riesgo importante para la diabetes y
enfermedades del corazón. Sin embargo, el consumo excesivo de fructosa y
glucosa por comer muchas frutas y verduras frescas no es probable.
Vegetales
Las
verduras frescas contienen de forma natural mínimo de glucosa y
fructosa. Vegetales no transformados que tienen una gama de fructosa y
contenido de glucosa entre 0,1 g y 1,5 g por 100 g de porción. Brócoli
fresco y aguacate tienen las cantidades más bajas, con alrededor de 0,1 g
de glucosa y fructosa en 100 g.Col blanca tiene 1,5 g de fructosa y 1,9
g de glucosa cuando se hierve. Aunque el chile contiene aproximadamente
2,3 g de fructosa, la cantidad utilizada es generalmente muy por debajo
de 100 g.
Frutas
Las
frutas tienen un contenido de fructosa más alto que las hortalizas.Las
frutas frescas tienen un rango de fructosa y contenido de glucosa entre
0,5 g y 9,5 g por 100 g de porción. Lima tiene 0,5 g de fructosa y
glucosa; pomelo contiene 1,8 g de fructosa y glucosa, las uvas contienen
9,5 g de fructosa y 7,1 g de glucosa. Para aquellos con intolerancia a
la fructosa, intolerancia alimentaria Diagnóstico en Australia sugiere
que es más útil examinar la fructosa en glucosa ratio, ya que los
alimentos se toleran mejor cuando tienen la misma cantidad de glucosa y
fructosa. Las frutas con un contenido de fructosa de 3 gramos o más por
porción deben limitarse. Ejemplos son manzana, cereza, melones, naranja,
papaya, pera, caqui y piña.
Frutas y vegetales procesados
Frutas
y hortalizas secas, conservas y procesados comercialmente contienen
mucho mayor cantidad de fructosa y glucosa que provienen de la
utilización de edulcorantes y conservantes tales como el jarabe de maíz
de alta fructosa. Las frutas secas promedian aproximadamente 30 g de
fructosa y glucosa por cada 100 g de porción, mientras que conserva y
frutas procesadas comercialmente contienen entre 6 y 12 g de fructosa y
glucosa.
Consideraciones
Si
bien es prudente que las personas con intolerancia a la fructosa para
limitar o evitar ciertos alimentos, la mayoría lo desea, puede centrarse
en limitar los alimentos procesados con adición de edulcorantes,
porque este tipo de alimentos también puede aumentar los niveles de
colesterol. En un estudio publicado en el "Journal of Clinical
Endocrinology Metabolism", encontraron los investigadores de la
Universidad de California, Davis, que cuando los participantes
consumieron altas dosis de fructosa, en 25 por ciento o más del consumo
total de energía, apo B, un mal tipo de colesterol, aumentó
significativamente en dos semanas, en comparación con aquellos que
consumieron glucosa.
TEMA 4
La
fructosa es un azúcar que se absorbe en el intestino delgado, donde pasa a la
sangre y penetra en la célula sin necesidad de insulina, por eso no eleva la
glucemia. Pero si se toma fructosa como edulcorante y la cantidad que se
toma es elevada, puede tener efectos perjudiciales para la salud.

Como
sabes, la fructosa es un azúcar, es el azúcar de la fruta y de la miel. También se conoce con el nombre
de levulosa. Es un monosacárido.
El azúcar
de mesa es la sacarosa, un disacárido formado por la unión de glucosa más fructosa.

El
almidón es un hidrato de carbono complejo formado por la acción de muchas unidades de
glucosa.
Imaginemos
que una persona no tiene ninguna enfermedad y toma fruta. La fructosa contenida
en esa fruta llega al hígado, es quemada y produce energía, y no hay ningún
problema. Los problemas pueden venir cuando tomamos alimentos a los que le
han añadido fructosa para hacerlos más dulces.
¿Por qué puede haber problemas si tomamos alimentos a los que le han
añadido fructosa?
Mira, la
glucosa, te insisto: “la glucosa”, es utilizada por todas las células del
organismo para ser quemada y producir energía, sin embargo la fructosa la
metabolizan casi solo las células del hígado.
- Si tomamos mucha fructosa y no necesita ser quemada para producir energía, a partir de la fructosa, en el hígado, se sintetiza, se forma grasa y puede llegar a producir un hígado graso no alcohólico.
- Además, el consumo excesivo de fructosa puede ocasionar resistencia a la insulina, esto quiere decir que la insulina no hace bien su efecto y para que no aumente el azúcar en la sangre el páncreas tiene que esforzarse y producir más insulina, favoreciendo el desarrollo de la diabetes.
- Además, el consumo excesivo de fructosa produce aumento de triglicéridos, disminución del colesterol bueno e hipertensión arterial, e incluso se ha asociado al aumento de ácido úrico y por tanto de gota.
¿Entonces tomar mucha fruta es malo?
Quiero
dejar claro que tomar fruta y verdura es muy bueno para la salud de las
personas. Ahora aclaremos el concepto de “mucho” y para ello te voy a
contar una anécdota:
Hace 35
años yo era residente de Endocrinología y Nutrición, estaba viendo a un
paciente diabético y me preguntó si podía comer tomate. Yo le dije que podía
comer el tomate que quisiera, y su mujer que estaba presente me dijo: “no le
diga usted eso porque se come 3 kg al día de tomates”. Por supuesto que yo le
dije que eso era una exageración y que podía comer tomate, pero 2-3 al día.
Desde entonces yo aprendí que siempre hay que puntualizar, y en el tema de
alimentación mucho más. Por tanto, comer fruta es bueno, y comer verdura es
bueno. Se puede y se debe de comer en torno a 400 gramos de fruta y 400
gramos de verdura al día. Tomar esta cantidad de fruta y verdura aunque
lleve fructosa no solo no es malo para la salud, sino que es muy beneficioso.
Los problemas pueden venir como te he dicho antes cuando se añade fructosa a
otros alimentos.
¿A qué alimentos se les suele añadir fructosa?
A zumos,
leche a la que le han quitado la lactosa y le han puesto fructosa,
productos de repostería, en muchos productos para diabéticos, en alimentos
procesados, etc.
También
hay fructosa para poder echar a los alimentos como si fuera azúcar de mesa
(sacarosa).
Hazme un resumen de la fructosa.
- Comer fruta y verdura en las cantidades recomendables es muy beneficioso para la salud.
- Mirar bien la etiqueta de información nutricional de los alimentos, y si le han puesto fructosa, en principio este no es beneficioso para la salud. Si un día tomamos un alimento al que le hayan añadido fructosa no pasa nada. El problema está en tomar de forma habitual alimentos a los que han añadido fructosa.
¿Por qué a los alimentos para diabéticos le ponen fructosa?
La
fructosa se absorbe en el intestino delgado y pasa a la sangre, pudiendo
penetrar en la célula sin necesidad de insulina, por eso no eleva la glucemia,
es decir, no eleva el nivel de glucosa en sangre.
Sin
embargo, la fructosa añadida a los alimentos, si es en una cantidad
importante, puede producir aumento de triglicéridos, resistencia a la insulina,
aumento de la tensión arterial, y a veces malestar intestinal. Si se toma
fructosa como edulcorante, y la cantidad que se toma es elevada, sucede todo lo
que te he explicado antes.
Otros
artículos de interés:
- ¿Qué es la malabsorción de la fructosa?
- ¿Que es la intolerancia a la fructosa?
- Sucralosa, un edulcorante que se obtiene de la sacarosa
- Estevia, un edulcorante natural obtenido de la planta estevia
- Aspartamo, edulcorante teóricamente seguro salvo en personas que tienen fenilcetonuria
- Ciclamato, un edulcorante prohibido en algunos paises
- La sacarina ¿es o no cancerígena?
proyecto.
TEMA 5
Extracción de aceite de orégano
TEMA 5
Extracción de aceite de orégano
El orégano, (Origanum vulgare), pertenece a la familia Labiaceae, y es una planta herbácea vivaz muyaromática (Carhuapoma, 2006; Arcila-Lozano et al., 2004;D’Antuonoet al.,2000). Sus hojas (tanto frescas como secas) se emplean como condimento en numerosas recetas culinarias por el excelente sabor que le confieren a las comidas (Albadoet al. , 2001). Se ha demostrado que el orégano contiene aceites esenciales, por lo que no solo es benéfico para la salud humana, sino que además puede sustituir los aditivos sintéticos de los alimentos (Arcila-Lozano et al., 2004). El AE de O. vulgaretiene actividad antiradicalaria y esta propiedad se le atribuye a los mono fenoles carvacrol y timol principales quimiotipos, cada una con enzimas específicas que dirigen su biosíntesis (D ́Antuono et al. , 2000; Deightonet al.,1993). Sobre la composición química del orégano, y sus aceites esenciales se han identificado flavonoides como la apigenina y la luteolina, agliconas, alcoholes alifáticos, compuestos terpénicos y derivados del fenilpropano(Arcila-Lozanoet al., 2004), también se han encontrado ácidos coumérico, ferúlico, caféico, r-hidroxibenzóico y v ainillínico (D ́Antuonoet al., 2000).
La subespecieOreganum vulgare ssp. Hirtumes la más estudiada, especialmente en relación a la composición y calidad de su aceite esencial, ya que esteúltimo tiene un importante valor comercial (Albadoet al., 2001; Arcila-Lozanoet al., 2004)
. En esta subespecie el rendimiento del aceite esencial en la hoja seca, varía entre 2% y 6% (Deightonet al., 1993).Este porcentaje se ve afectado por la altitud del lugar de cultivo (Carhuapoma, 2006), y por la época de ecolección, siendo este más bajo en el otoño (Arcila-Lozano et al., 2004). En el aceite del orégano que crece en forma silvestre se ha observado que un incremento en los porcentajes de timol provoca unadisminución en el contenido de carvacrol (Albado et al., 2001). De igual manera, los hidrocarburos monoterpenoides, terpineno y r-cimeno están presentes de manera constante en los aceites esenciales delorégano, pero siempre en cantidades menores (Arcila-Lozano et al., 2004). Recientemente, Stashenkoetal., (2010), caracterizaron tres grupos de orégano de monte presentes en Colombia en relación con la composición de los aceites esenciales: El Quimiotipo A que es rico en compuestos terpénicos(monoterpenos y sesquiterpenos que representan el 45 y 27%, respectivamente); el Quimiotipo B, cuyo principal componente es el carvacrol (40%) seguido
de p-cimeno (13%) y g-terpineno (11%) y timol (11%).Este quimiotipo es similar al encontrado en Brasil (Oliveira et al., 2004); el quimiotipo C posee altos niveles de timol (56%, seguido de p-cimeno (9%) y g- terpineno(5%), este quimiotipo es similar a los reportados en Venezuela por Albado et al., (2001) y Arcila-Lozanoet al., (2004).Se han realizado diversos estudios sobre la bioactividad del orégano; es así como lo citan como antioxidante (Fasseaset al., 2007), antitripanosoma (Santoroet al., 2007), igualmente activo para un amplio grupo de bacterias patógenas (Albadoet al., 2001). Asimismo, se ha aprovechado su doble ventaja en
cuanto a las propiedades sensoriales y el tiempo de conservación del aceite esencial de orégano en pescado, prolongando el tiempo de vida útil del producto en comparación con otros métodos de conservación (Viuda-Martoset al.,2009).
Revisar
http://www.scielo.cl/pdf/infotec/v24n4/art05.pdf
http://www.scielo.cl/pdf/infotec/v24n4/art05.pdf
Revisar
http://www.scielo.cl/pdf/infotec/v24n4/art05.pdf
http://www.scielo.cl/pdf/infotec/v24n4/art05.pdf
IEMA 6
ACEITE DE BARBASCO.
viernes, 5 de agosto de 2011
Naturaleza Vs Ciencia
Problema:
En la actualidad, existe mucha contaminacion ambiental, los vegetales y las plantas ya no son igual que antes, los insectisidas que se le aplican estan muy modificados quimicamente, que ahora hasta crecen en la mitad del tiempo establecido, Entonses ¿Podra alguna planta reemplazar las funciones que cumple un insecticida en el control de plagas, crecimiento y asimilacion de las mismas?
Hipotesis:
Sí, en este proyecto nosotras presentamos a la planta de Barbasco,que ahora hecha extracto sirve para reemplazar las funciones de un insecticida químido, por uno biodegradable, que a su vez, nutre y enriquece en mayor porcentaje el crecimientos de estas, teniendo en cuenta que su uso es venefactorio tanto para el ambiente, como para nuestro organismo.
Observaciones:
En la actualidad, existe mucha contaminacion ambiental, los vegetales y las plantas ya no son igual que antes, los insectisidas que se le aplican estan muy modificados quimicamente, que ahora hasta crecen en la mitad del tiempo establecido, Entonses ¿Podra alguna planta reemplazar las funciones que cumple un insecticida en el control de plagas, crecimiento y asimilacion de las mismas?
Hipotesis:
Sí, en este proyecto nosotras presentamos a la planta de Barbasco,que ahora hecha extracto sirve para reemplazar las funciones de un insecticida químido, por uno biodegradable, que a su vez, nutre y enriquece en mayor porcentaje el crecimientos de estas, teniendo en cuenta que su uso es venefactorio tanto para el ambiente, como para nuestro organismo.
Observaciones:
miércoles, 3 de agosto de 2011
Usos y Aplicaciones
Especificaciones técnicas:
Apariencia: Extracto, harina, triturado, resina.
Color: Característico.
Olor: Característico.
Principio activo: Rotenona al 98%, 70% y 40% (+ / - 1).
Fórmula química: C23 H22 O6
Peso molecular: 394.43
Punto de fusión: 163 ºC
Solubilidad: Soluble en solventes orgánicos.
Poco soluble en agua caliente.
Estabilidad: La luz solar y el calor degradan la rotenona.
Se oxida rápidamente en presencia de alkalis.
Mejora su acción cuando trabaja en medio ácido.
Efectos Ecológicos: Rotenona es biodegradable. No destruye el ecosistema. No es fitotóxico. No es tóxico para las abejas, pero sí muy tóxico para los peces.
Rotenona es un insecticida y pesticida natural, obtenido mediante una extracción por solventes a partir de las raíces del barbasco o cube (Lonchocarpus nicou L).
Rotenona es un insecticida natural selectivo por contacto, no sistémico, con propiedades acaricidas y parasiticidas. Está considerado como un insecticida botánico y cuyo uso general es como pesticida.
Rotenona se emplea en la fabricación de insecticidas naturales orgánicos biodegradables. Con el piretro generan una acción sinergista mejorando su efectividad en el momento de su aplicación.
Combaten todo tipo de insectos voladores y rastreros.
Apariencia: Extracto, harina, triturado, resina.
Color: Característico.
Olor: Característico.
Principio activo: Rotenona al 98%, 70% y 40% (+ / - 1).
Fórmula química: C23 H22 O6
Peso molecular: 394.43
Punto de fusión: 163 ºC
Solubilidad: Soluble en solventes orgánicos.
Poco soluble en agua caliente.
Estabilidad: La luz solar y el calor degradan la rotenona.
Se oxida rápidamente en presencia de alkalis.
Mejora su acción cuando trabaja en medio ácido.
Efectos Ecológicos: Rotenona es biodegradable. No destruye el ecosistema. No es fitotóxico. No es tóxico para las abejas, pero sí muy tóxico para los peces.
Rotenona es un insecticida y pesticida natural, obtenido mediante una extracción por solventes a partir de las raíces del barbasco o cube (Lonchocarpus nicou L).
Rotenona es un insecticida natural selectivo por contacto, no sistémico, con propiedades acaricidas y parasiticidas. Está considerado como un insecticida botánico y cuyo uso general es como pesticida.
Rotenona se emplea en la fabricación de insecticidas naturales orgánicos biodegradables. Con el piretro generan una acción sinergista mejorando su efectividad en el momento de su aplicación.
Combaten todo tipo de insectos voladores y rastreros.
Nuestra vista hacia el futuro .. Barbasco Ecológico.
El
extracto del barbasco, es un formulado concentrado orgánico de origen
vegetal, totalmente biodegradable, cuyos compnentes naturales de acción
insectífuga e insectisida, se extraen por porcesos de fermentación
enzimática y microbacteriana de las raíces de este, en forma de resinas
complejas que luego se solubilizan y estabilizan en una formulación
liquida de alcoholes y tensioactivos de origen vegetal. Esta es una
planta que a travéz de miles de años, ha sido usada por los nativos de
la selva peruana en la caza de peces, para su alimentacion y que en esta
formulacion especial,, muestra propiedades exelentes para el manejo del
control de algunas plagas insectiles, de manera segura para el medio
ambiente y el ser humano.
Esta fusión no produce resistencia genética en las plagas, no altera el medio ni afecta a los predatores y parasitoides, ni a las abejas. Presenta una mínima toxicidad para el hombre y los animales de sanfre caliente.
Esta fusión no produce resistencia genética en las plagas, no altera el medio ni afecta a los predatores y parasitoides, ni a las abejas. Presenta una mínima toxicidad para el hombre y los animales de sanfre caliente.
Barbasco, una oportunidad para cuidar el medio ambiental.
En los inicios del siglo XXI, el consumidor comenzó a preocuparse por la inocuidad de los alimentos que consumía. Lo último dicho abarcaba la calidad de los alimentos, los fertilizantes que se utilizaban, cuán propicio era la tierra que se utilizaba entre otros detalles que le generaban valor agregado a los alimentos en el mercado internacional. Por ello, este pensamiento ecológico, que no tan sólo abarca la siembra, la cosecha y la comercialización de los alimentos, sino también de técnicas amigables con el medio ambiente, le abrió la puerta al Perú para trabajar en una agricultura orgánica.
Esta nueva corriente del cuidado de la salud y el medio ambiente en Europa, Estados Unidos y Japón, han generado la posibilidad de que las exportaciones peruanas de productos orgánicos se incrementen en los últimos años. A su vez, genere trabajo y desarrollo a un mayor número de regiones a nivel nacional. Para la práctica de una agricultura orgánica, se comenzaron a utilizar fertilizantes biodegradables, inofensivos para el ecosistema. Este nuevo tipo de fertilizantes tienen en su composición, heces de animales y, en otros casos, compuestos por diversidad de plantas que juntas favorecen a una mejor calidad de suelo para tener óptimas cosechas. Entre estos fertilizantes, encontramos el barbasco en polvo, que contiene una sustancia llamada Rotenona, la cual es muy útil para el agro y la ganadería. El presente trabajo es dedicado a la exploracion del barbasco, tomando en cuenta algunos puntos importantes para su estudio y uso, como por ejemplo, Generalidades, Modo de acción, usos y precauciones, etc.
TEMA 7
INSECTICIDA ABASE DE AJI Y BARBASCO
http://marthali-abonosorganicos.blogspot.com/2011/08/insecticida-de-aji-y-barbasco.html
miércoles, 24 de agosto de 2011
INSECTICIDA DE AJI Y BARBASCO
PROTOCOLO PARA LA ELABORACION DE INSECTICIDA A BASE DE AJÍ Y BARBASCO
JUSTIFICACIÓN:
En la actualidad resulta de gran importancia investigar
y encontrar las variantes que nos permitan el desarrollo de una
agricultura rentable y no contaminante del medio ambiente. Por otra
parte, el uso de productos químicos en la agricultura aumenta
notablemente los rendimientos y la rentabilidad de los cultivos, pero la
utilización constante de estos puede alterar el medio biológico
produciendo graves daños en los diversos ecosistemas.
En
aras de una agricultura sostenible es determinante la implementación de
prácticas para el control de plagas que minimicen el impacto ambiental y
que de igual forma sean de fácil elaboración y consecución para los
productores agrícolas.
OBJETIVOS
1. Minimizar costos en el manejo de plagas.
2. Producir alimentos libres de contaminantes químicos
3. Propender por la sostenibilidad de la producción agrícola.
4. Implementar técnicas de producción agrícola amigables con el medio ambiente
FUNDAMENTOS TEÓRICOS:
A
partir de la necesidad por encontrar una nueva alternativa natural para
el control de insectos plagas y reemplazar así los pesticidas
sintéticos aparecen los insecticidas botánicos ofreciendo seguridad para el medio ambiente y una eficiente opción agronómica. (Borembaum, 1989).
Muchas
plantas son capaces de sintetizar metabolitos secundarios que poseen
propiedades biológicas de importancia contra insectos plagas. (Matthews,
1993; Enriz, 2000; Calderón, 2001; Céspedes, 2001; Gonzalez-Coloma;
2002). La selección de plantas que contengan metabolitos secundarios
capaces de ser utilizados como insecticidas naturales debe ser de fácil
cultivo y con principios activos potentes, con alta estabilidad química y de óptima producción.
La rotenona, extraída de una planta llamada derris y barbasco (Derris elliptica y Lonchocarpus utilis, Fam. Leguminosae) es
un flavonoide que se extrae de las raíces de estas plantas. De la
primera se puede obtener un 13% de rotenona mientras que de la segunda
un 5%. Derris es nativa de los trópicos orientales, mientras que Lonchocarpus es del hemisferio occidental. Este compuesto es un insecticida de contacto e ingestión, y repelente. Su modo de acción implica una inhibición del transporte de electrones a nivel de mitocondrias bloqueando la fosforilación del ADP a ATP. Por esto se dice que actúa inhibiendo el metabolismo del insecto. Los síntomas que presentan los insectos intoxicados con rotenona son: disminución del consumo de oxigeno, depresión en la respiración y ataxia que provocan convulsiones y conducen finalmente a la parálisis y muerte del insecto por paro respiratorio (Silva, 2002)
La nicotina es un alcaloide derivado especialmente de tabaco (Nicotiana tabacum
Fam. Solanaceae). Sus propiedades insecticidas fueron reconocidas en la
primera mitad del siglo XVI. Este compuesto no se encuentra en la
planta en forma libre sino que formando maleatos y citratos. La nicotina
es básicamente un insecticida de contacto no persistente. Su modo de
acción consiste en mimetizar la acetilcolina al combinarse con su
receptor en la membrana postsináptica de la unión neuromuscular. El
receptor acetilcolínico, es un sitio de acción de la membrana
postsináptica que reacciona con la acetilcolina y altera la
permeabilidad de la membrana; la actividad de la nicotina ocasiona la
generación de nuevos impulsos que provocan contracciones espasmódicas,
convulsiones y finalmente la muerte. Hoy en día se encuentran en el mercado un grupo de insecticidas conocidos como neonicotinoides que son copias sintéticas o derivadas de la estructura de la nicotina como son Imidacloprid, Thiacloprid, Nitempiram, Acetamiprid y Thiamethoxam entre otros.
La inhibición que produce
este extracto de tabaco a altas concentraciones se debe a que contiene
nicotina, un alcaloide que en altas concentraciones inhibe la actividad
metabólica y retrasa el crecimiento, este alcaloide es efectivo también
sobre el control de plagas, pero a demás este extracto puede contener
también otras sustancias como: ácidos fenólicos, cumarinas, flavonoides y
terpenoides que también son capaces de causar el mismo efecto. La
estimulación en bajas concentraciones del extracto puede deberse a la
presencia en este de sustancias hormonales como: giberelina,
citoquinina, y auxinas que aumentan
el nivel hormonal del medio, lo que favorece el crecimiento, esto
ocurre ya que este efecto estimulante a bajas concentraciones no está
opacado por el efecto inhibitorio de las sustancias inhibidoras.
PREPARACIÓN DEL INSECTICIDA A BASE DE BARBASCO Y TABACO
Ingredientes:
ü ½ Libra de Barbasco Verde
ü 20 Tabacos o 150 gr de hojas secas
ü 10 Cucharadas de alcohol
ü 20 Litros de agua
ü ¼ Jabón común
Preparación:
Se
desmenuza el tabaco y se muele el barbasco, en un recipiente plástico
con el barbasco y el tabaco, se vierten 5 litros de agua hirviendo, se
deja en reposo por 24 horas.
Al
cabo de este tiempo, se filtra la mezcla de tabaco y barbasco y se
vierte en la bomba de 20 litros, se derrite el jabón en un litro de agua
y se añade a la bomba, por último se añaden las 10 cucharadas de
alcohol.
Se completa la bomba con el agua restante.
Bioestimuladores de Crecimiento


Bioestimuladores de Crecimiento
Las
plantas, para crecer, además de agua, nutrientes, luz solar y dióxido de
carbono, necesitan hormonas. Las fases del desarrollo vegetal están
reguladas por diferentes sustancias químicas reguladores de crecimiento,
fitohormonas y hormonas vegetales.
Las
hormonas vegetales son unas sustancias orgánicas que se encuentran a muy baja
concentración, se sintetizan en determinado lugar de la planta y se translocan
a otro, que es donde ejercen sus efectos reguladores; hasta el momento se
conocen cinco grupos de fitohormonas:


- Auxinas
El término auxinas del griego Auxein aumentar,
crecer, agrupa a una serie de compuestos químicos naturales o sintéticos que
causan diversos efectos biológicos a las diferentes especies vegetales ó
variados efectos en una misma especie, dependiendo de la etapa fenológica en
que se efectúe su aplicación. Como ejemplo de la variedad de respuestas,
la Auxina más típica es el Àcido Indolacético (AIA) deriva del triptófano
y se sintetiza principalmente en ápices del brote y en las raíces; se
transportan de célula a célula por el floema. Entre algunas
respuestas fisiológicas, provoca estimulación del crecimiento del tallo,
estimulación de la división celular, inhibición del crecimiento radical,
control sobre la diferenciación del sistema vascular y sobre la
dominancia apical, retraso en la senescencia, promoción de la floración, así
como amarre y maduración de frutos (Larqué-Saavedra y Rodríguez-González,
2004). Una de las aplicaciones más importantes que se le adjudican a los
compuestos auxínicos es la estimulación de la formación de raíces en la
reproducción de ejemplares.
Giberelinas
Las giberelinas son el grupo más numeroso de
hormonas vegetales que se conoce en la actualidad; existen más de 100
giberelinas en plantas superiores, pero unas pocas tienen actividad biológica.
La mejor conocida del grupo, es el ácido giberélico GA3, producido por el hongo
Giberella fujikuroi. Las giberelinas son sintetizadas en los primordios
apicales de las hojas, en puntas de las raíces, en los frutos, tejidos jóvenes
y semillas en desarrollo. Se sintetizan por la vía de los terpenoides.
Algunos de los efectos que induce esta hormona es la inducción del crecimiento
del tallo, regulación de la transición entre la fase juvenil y el adulto,
inducción de la floración y la determinación sexual de la flor, inducción de la
germinación además de promover la enlongación intermodal. La respuesta
más observada en las plantas superiores, es un incremento notable de
crecimiento del vástago: a menudo, los tallos se vuelven largos y delgados, con
pocas ramas, y las hojas palidecen, estimula la producción de la enzima
a-amilasa y otras enzimas en la germinación de granos de cereales para la
movilización de las reservas de la semilla.
Citoquininas
Las citoquininas son los compuestos que promueven
la división de la célula en tejidos no meristemáticos. Estos compuestos se han
encontrado en todas las plantas, particularmente en los tejidos que se dividen
en forma activa como meristemos, semillas en germinación, frutos en maduración
y raíces en desarrollo. Las citoquininas se han detectado en concentraciones
generalmente inferiores a las restantes fitohormonas. Se han detectado tanto en
el floema como en el xilema y su transporte en la planta es por vía acropétala,
desde el ápice de la raíz, hasta los tallos moviéndose a través de la savia en
los vasos correspondientes al xilema. Los diferentes tipos de citoquininas son
zeatina (zea mays), kinetina y benziladenina. Los efectos fisiológicos causados
por la citoquininas varían dependiendo del tipo de citoquinina y la especie de
la planta: estimulan la división celular y el crecimiento de yemas laterales,
formación de callos en presencia de auxinas, retrasan la senescencia e inhiben
la dominancia apical entre otros efectos.
Ácido Abcísico
El ácido abcísico (ABA) se caracteriza por inhibir
muchos fenómenos de crecimiento en las plantas superiores (antagonista de
auxinas, citoquininas y giberelinas), y por estar asociada a la dormición de
yemas y semillas; y como su nombre lo indica, a la abscisión de hojas,
tolerancia al estrés ambiental principalmente al estrés hídrico promoviendo la
síntesis de proteínas protectoras, promueve el crecimiento de la raíz y el
cierre de estomas. Esta hormona juega un papel regulador en
respuestas fisiológicas como el letargo, abscisión de hojas. La biosíntesis
tiene lugar en semillas, frutos, tallos y raíces.
Etileno
El etileno es una hormona natural de la planta que
se conoce desde hace muchísimos años, fue usado en Egipto en donde se trataban
con gas los higos para estimular su maduración. Se produce en casi todos los
órganos de las plantas superiores, aunque la tasa de producción depende del
tipo de tejido y su estadío de desarrollo. Promueve la maduración de los frutos
(climatéricos) y la senescencia (flores y hojas), induce la abscisión de las
hojas y promueve el crecimiento lateral (pérdida de gravitropismo) la cual es
importante durante la germinación.
También existen numerosas sustancias
sintéticas que pueden ser análogas o no en estructura química a las
fitohormonas, las cuales suelen presentar una actividad biológica muy
similar a ciertas hormonas vegetales.
Se
consideran reguladores de crecimiento a los compuestos orgánicos, naturales o
sintéticos que modifiquen o inhiban en cierta cantidad el crecimiento o
desarrollo de la planta siempre que lo hagan de manera similar a como actúan
las hormonas vegetales (Lluna, 2006).
Julius
von Sachs (1887) definió a las fitohormonas como señales químicas que permiten
la comunicación entre las células; estas regulan el crecimiento y desarrollo a
través de regulación de patrones de división celular, expansión celular,
diferenciación celular y metabolismo celular; el efecto depende de la
concentración en el tejido (transporte, síntesis, degradación) y la
sensibilidad del tejido; así mismo, actúan en muy bajas concentraciones, pueden
actuar sobre tejidos cercanos o distantes, pueden tener actividad inductora o
inhibidora
Algunos
de los efectos fisiológicos más importantes causados por hormonas vegetales en
las plantas.
Efecto
fisiológico
Respuestas
trópicas
Crecimiento
de secciones de coleoptilos de avena
Aumento
del tamaño celular en cultivo de tejidos
Control
de la diferenciación en cultivo de tejidos
Estimula
el enraizamiento en estaquillas
Inhibe
el desarrollo radicular Estimula la división del cambium
Abscisión
de hojas y frutos
Activa el
crecimiento de furtos
Afecta
el crecimiento del tallo
Interrumpe
el reposo de las yemas vegetativas
Favorece
la germinación en algunas semillas
Mantenimiento
de la dominancia apical
Inhibe
la degradación de proteínas y clorofilas en la senescencia
Aumenta
la respiración del fruto durante la maduración
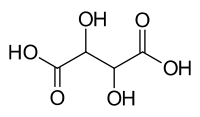


SI SELECCIONO SU TEMA DE INTERÉS, REGISTRARSE AQUI
ResponderEliminarprofe quiero realizar el tema de extraccion de aceite de oregano
ResponderEliminar